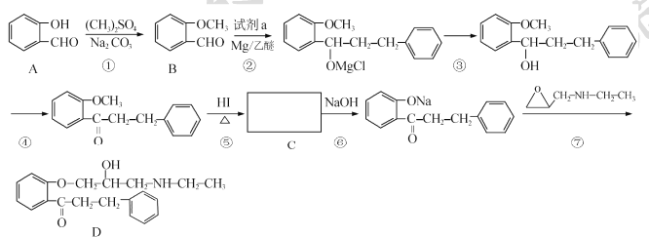
题目内容
【题目】用铁、铝混合物进行如下实验:
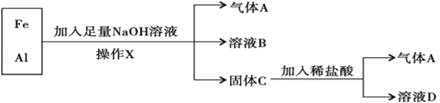
操作X的名称是_____,若铝和铁的物质的量相等,前后两次生成气体A的物质的量之比为______,溶液B中阴离子除OH﹣外还有______,溶液D中存在的金属离子主要为______。
【答案】过滤 3:2 AlO2- Fe2+
【解析】
实现固体和液体的分离采用过滤的方法;生成的气体A为H2,根据电子守恒计算出生成H2的物质的量之比;根据金属铝和氢氧化钠反应,而金属铁和氢氧化钠溶液不反应,但是可以和盐酸反应来回答。
Fe、Al混合物中加入NaOH溶液,Al会发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al变为NaAlO2进入溶液,溶液B中含有NaAlO2、NaOH,所以溶液B中阴离子除OH﹣外还有AlO2-;而Fe不能发生反应,分离固体与液体混合物的操作X为过滤;根据方程式可知2 mol Al与NaOH溶液反应后会产生3 mol H2;反应后过滤得到的固体C为Fe,向其中加入稀盐酸,发生反应:Fe+2HCl=FeCl2+H2↑,1 mol Fe完全反应产生H2的物质的量是1 mol,则2 molFe反应产生H2的物质的量为2 mol,所以等物质的量的Al、Fe前后两次反应产生H2的物质的量为3:2;溶液D为FeCl2,溶液中存在的阳离子为Fe2+。

【题目】某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
Ⅰ.实验步骤:(请填空)
(1)滴定管在使用前应先检验是否漏液,然后用蒸馏水洗涤,最后用____润洗。
(2)将氢氧化钠溶液装入滴定管排除气泡并调节液面。如果液面初始位置如图所示,则此时的读数为____mL。
![]()
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察____(选填编号).
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
Ⅱ.实验记录:
实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
初读数 | 末读数 | 消耗体积 | ||
1 | 15.00 | 0.50 | 17.75 | ____ |
2 | 15.00 | 0.05 | 16.10 | 16.05 |
3 | 15.00 | 0.00 | 15.95 | 15.95 |
(4)请填写1组反应消耗的氢氧化钠溶液体积。
Ⅲ.数据处理与讨论:
(5)处理数据时应舍去误差明显过大的异常数据,余下的数据中NaOH溶液的平均消耗值是___mL。若NaOH标准溶液的浓度为0.1020mol/L,该盐酸的浓度为___mol/L。
(6)在本实验过程中,下列操作不会造成实验误差的是___(选填编号)。
a.锥形瓶中加入待测溶液后,再加少量蒸馏水
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出
c.见到指示剂的颜色有变化即停止滴定