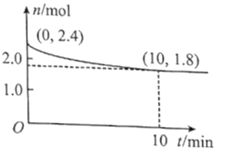
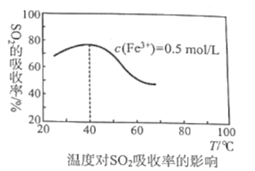
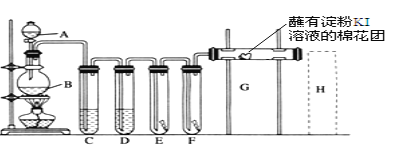
题目内容
【题目】某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
Ⅰ.实验步骤:(请填空)
(1)滴定管在使用前应先检验是否漏液,然后用蒸馏水洗涤,最后用____润洗。
(2)将氢氧化钠溶液装入滴定管排除气泡并调节液面。如果液面初始位置如图所示,则此时的读数为____mL。
![]()
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察____(选填编号).
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
Ⅱ.实验记录:
实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
初读数 | 末读数 | 消耗体积 | ||
1 | 15.00 | 0.50 | 17.75 | ____ |
2 | 15.00 | 0.05 | 16.10 | 16.05 |
3 | 15.00 | 0.00 | 15.95 | 15.95 |
(4)请填写1组反应消耗的氢氧化钠溶液体积。
Ⅲ.数据处理与讨论:
(5)处理数据时应舍去误差明显过大的异常数据,余下的数据中NaOH溶液的平均消耗值是___mL。若NaOH标准溶液的浓度为0.1020mol/L,该盐酸的浓度为___mol/L。
(6)在本实验过程中,下列操作不会造成实验误差的是___(选填编号)。
a.锥形瓶中加入待测溶液后,再加少量蒸馏水
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出
c.见到指示剂的颜色有变化即停止滴定
【答案】氢氧化钠溶液 0.70 b 17.25 16.00 0.1088mol/L a
【解析】
(1)滴定管使用前应用待装液润洗,以防止被稀释,
故答案为:NaOH标准溶液;
(2)滴定管液面的读数0.70mL,
故答案为:0.70;
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化,根据溶液颜色的变化判断终点;
答案选b;
(4)初读数0.50mL,末读数17.75mL,则消耗氢氧化钠溶液体积为17.25mL;
故答案为:17.25;
(5)三次滴定消耗标准液体积分别为:17.251mL、16.05mL、15.95mL,第一组数据误差较大,应该舍弃,另外两组实验中消耗标准液平均体积为:![]() =16.00mL,
=16.00mL,
NaOH~HCl
0.1020mol/L×16.00mL c(HCl)×15.00mL
解得:c(HCl)=0.1088mol/L
故答案为:16.00;0.1088;
(6)a.锥形瓶中加入待测溶液后,再加少量蒸馏水,导,待测液的物质的量不变,标准液的体积不变,结果不变,故a错误;
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=![]() 分析,可知c(待测)偏小,故b错误;
分析,可知c(待测)偏小,故b错误;
c.见到指示剂的颜色有变化即停止滴定,造成V(标准)偏小,根据c(待测)=![]() 分析,可知c(待测)偏小,故c错误;
分析,可知c(待测)偏小,故c错误;
答案选a。

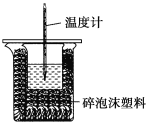
【题目】某实验小组用100mL0.50mol/LNaOH溶液与60mL0.50mol/L硫酸进行中和热的测定。装置如图所示,回答下列问题:
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体____g。
(2)图中装置缺少的仪器是____。
(3)硫酸稍过量的原因是____。
(4)请填写下表中的平均温度差:
实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似认为0.50 mol/L NaOH溶液与0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容为c=4.18J/(g℃)则上述实验中和热ΔH=___(取小数点后一位)
(6)上述实验结果与57.3kJ/mol有偏差产生偏差的原因可能是____
A.量取NaOH溶液时仰视读数
B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差
D.用铜丝代替玻璃棒搅拌