题目内容
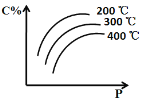
【题目】对于反应mA(s) + nB(g) ![]() eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
A. 化学方程式中n<e +f
B. 达到平衡后,若升温,v正减小,v逆增大
C. 达到平衡后,增加B的量,B的转化率增大
D. 若B为有色物质,达到平衡后缩小容器体积,重新达平衡后与原平衡比较气体颜色变浅
【答案】C
【解析】
首先看趋势,随着压强的增大,C%逐渐增大;说明增大压强,平衡正向移动,根据所学增大压强,化学平衡向气体体积减小的方向移动,则n>e+f。固定压强不变,可以知道随着温度的升高,C%降低,说明升高温度,平衡逆向移动;根据所学,升高温度向吸热反应方向移动,逆反应为吸热反应,则正反应为放热反应。
A.随着压强的增大,C%逐渐增大;说明增大压强,平衡正向移动,根据所学增大压强,化学平衡向气体体积减小的方向移动,则n>e+f;A项错误;
B.升高温度,不管是正反应速率还是逆反应速率均加快,B项错误;
C.由于A是固体,所以增加B的量,为等比例的加入反应物,从等效平衡的角度思考。加入反应B后,平衡效果相当于加压,增大压强向气体体积减小的方向移动,气体体积减小的方向为正反应方向,B的转化率增大,C项正确;
D.若B为有色物质,达到平衡后缩小容器体积,虽然平衡正向移动,但是新平衡中B的浓度比原平衡的大,颜色会加深,D项错误;
本题答案选C。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目