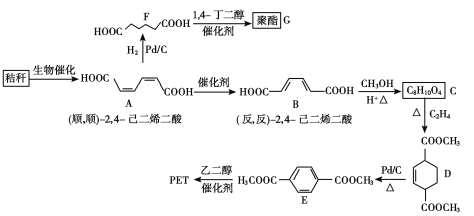
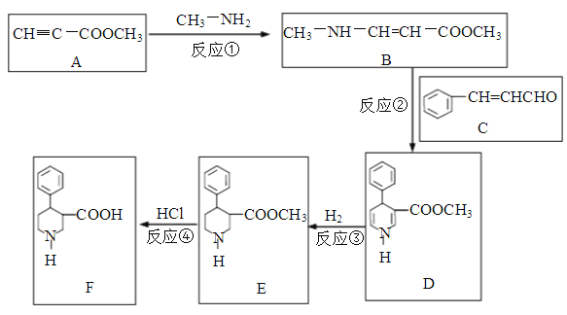
题目内容
【题目】镍具有良好的导磁性和可塑性,主要用于制作合金及催化剂。请回答下列问题
(1)基态镍原子的价电子排布图为____,同周期元素中基态原子与镍具有相同未成对电子的还有____种。
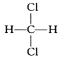
(2)四羰基合镍是一种无色挥发性液体,熔点-25℃,沸点43℃。则四羟基合镍中σ键和π键数目之比为___三种组成元素按电负性由大到小的顺序为____。
(3)[Ni(NH3)
4]SO4中N原子的杂化方式为____,写出与SO42-互为等电子体的一种分子和一种离子的化学式____,____;[Ni(
NH3)4]SO4中H-N-H键之间的夹角___(填“>”“<”或“=”)NH3分子中H-N-H键之间的夹角。
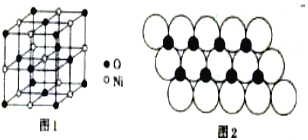
(4)已知NiO的晶体结构(如图1),可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中,则NiO晶体中原子填充在氧原子形成的____体空隙中,其空隙的填充率为____。
(5)一定温度下,NiO晶体可分散形成“单分子层”,O2-作单层密置排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为αm,每平方米面积上分数的NiO的质量为___g。(用a、NA表示)
【答案】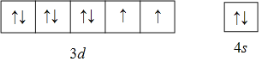 3 1:1 O>C>Ni sp3 CCl4 ClO4- > 正八面 100%
3 1:1 O>C>Ni sp3 CCl4 ClO4- > 正八面 100% ![]()
【解析】
(1)Ni是28号元素,其价电子为3d、4s能级上的电子;Ni原子核外有2个未成对电子,同周期元素中基态原子与镍具有相同未成对电子的还有Ti、Ge、Se元素;
(2)CO中含有1个σ键、1个π键,每个CO分子和Ni原子形成一个σ键,所以一个Ni(CO)4中含有σ键8个、π键8个;元素的非金属性越强,其电负性越大;
(3)[Ni(NH3)4]SO4中N原子的价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化类型,与SO42-互为等电子体的一种分子和一种离子中原子个数为5、价电子数为32;[Ni(NH3)4]SO4中N原子、NH3分子中N原子都采用sp3杂化,但是前者不存在孤电子对、后者含有1个孤电子对,成键电子对之间的排斥力小于成键电子对和孤电子对之间的排斥力;
(4)氧原子位于面心和顶点,Ni位于棱心和体心,由图可知体心Ni原子的配位数为6,故Ni位于6个面心O形成正八面体中心;其空隙的填充率为100%;
(5)平面NiO基本结构单元为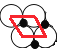 ,每个结构单元含有1个“NiO“,每个氧化镍所占的面积=(2a m)×(2a m×sin60°)=2
,每个结构单元含有1个“NiO“,每个氧化镍所占的面积=(2a m)×(2a m×sin60°)=2![]() a2m2,计算1个“NiO“的质量,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量。
a2m2,计算1个“NiO“的质量,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量。
(1)Ni是28号元素,其价电子为3d、4s能级上的电子;Ni原子核外有2个未成对电子,其价电子排布图为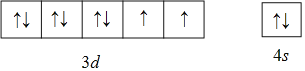 ;同周期元素中基态原子与镍具有相同未成对电子的还有Ti、Ge、Se元素,所以有3种元素,故答案为:
;同周期元素中基态原子与镍具有相同未成对电子的还有Ti、Ge、Se元素,所以有3种元素,故答案为: ;3;
;3;
(2)CO中含有1个σ键、1个π键,每个CO分子和Ni原子形成一个σ键,所以一个Ni(CO)4中含有σ键8个、π键8个,所以四羰基合镍中σ键和π键数目之比=8:8=1:1;元素的非金属性越强,其电负性越大,非金属性O>C>Ni,所以电负性O>C>Ni,故答案为:1:1;O>C>Ni;
(3)[Ni(NH3)4]SO4中N原子的价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化类型为sp3,与SO42-互为等电子体的一种分子如CCl4,一种离子如ClO4-;[Ni(NH3)4]SO4中N原子、NH3分子中N原子都采用sp3杂化,但是前者不存在孤电子对、后者含有1个孤电子对,成键电子对之间的排斥力小于成键电子对和孤电子对之间的排斥力,所以;[Ni(NH3)4]SO4中H-N-H键之间的夹角>NH3分子中H-N-H键之间的夹角,故答案为:sp3;CCl4;ClO4-;
(4)氧原子位于面心和顶点,Ni位于棱心和体心,由图可知体心Ni原子的配位数为6,故Ni位于6个面心O形成正八面体中心,其空隙的填充率为100%,故答案为:正八面;100%;
(5)平面NiO基本结构单元为 ,每个结构单元含有1个“NiO",每个氧化镍所占的面积=(2am)×(2am×sin60°)=2
,每个结构单元含有1个“NiO",每个氧化镍所占的面积=(2am)×(2am×sin60°)=2![]() a2m2,则每平方米含有的氧化镍个数=
a2m2,则每平方米含有的氧化镍个数=![]() ,每个氧化镍的质量=
,每个氧化镍的质量=![]() g,所以每平方米含有的氧化镍质量=
g,所以每平方米含有的氧化镍质量=![]() g×
g×![]() =
=![]() g,故答案为:
g,故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案