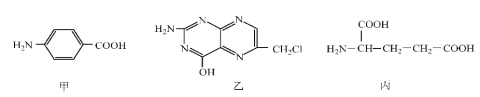
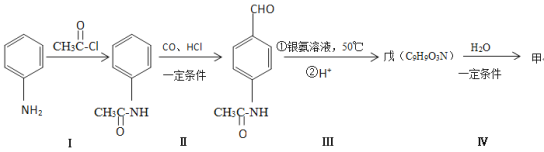
��Ŀ����
����Ŀ����ҵ�������̿�(ֻ��MnO2��MnO)��H2SO4(����)��FeS2�Ʊ�MnSO4��H2O����������(��֪�����е�FeS2��FeSO4��MnO2��MnO����ȫ��Ӧ)��
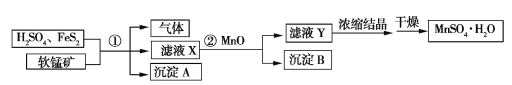
��1����֪����ֻ��������Ӧ������������Ӧ��
MnO+H2SO4MnSO4+H2O
FeS2+H2SO4FeSO4+H2S��+S��
��ɵ�������Ӧ��
___MnO2+___FeSO4+___ ____________MnSO4+___ _________+___ _________
��2������A��B�Ļ�ѧʽ�ֱ���____________________��__________________��
��3����ҺX�е�������__________��ʵ������Ũ����ҺYʱʹ�õIJ���������___________________��
��4�����õ��ij���A��������MnSO4��H2O�������ֱ�Ϊ96.0 g��321.1 g�����м����MnOΪ0.1 mol�������������̿���MnO2��MnO�����ʵ���֮��Ϊ____________��
���𰸡�1 2 2 H2SO4 1 1 Fe2(SO4)3 2 H2O S Fe(OH)3 MnSO4��Fe2(SO4)3��H2SO4 ���������ƾ��� 5��1
��������
��1���������⣬��Ӧ����Ҫ�������ᣬ�ṩ���Ի��������ݵ�ʧ�����غ��Ԫ���غ���ƽ����ʽ����2������������Ӧ����ʽ��ת����ϵ�жϳ���A����ҺX�м���MnO������Һ��pH����������Fe(OH)3��������3������������Ӧ����ʽ�ж���ҺX�е���������������Ũ��������������4�����ݹ�ϵʽ��2S~2FeSO4~MnO2������MnO2�����ʵ�����������Ԫ���غ�������̿���MnO�����ʵ�����
��1����Ӧ����Ҫ�������ᣬ�ṩ���Ի�������Ԫ�ػ��ϼ���+4��Ϊ+2��������Ԫ�ػ��ϼ���+2����Ϊ+3�������������ɣ�����Ԫ���غ㣬�����л���ˮ���ɣ����Է�Ӧ����ʽ�� 1 MnO2+2_FeSO4+2H2SO41 MnSO4+ 1 Fe2(SO4)3+2H2O����2������FeS2+H2SO4FeSO4+H2S��+S����֪����AΪ���ʣ���ҺX����MnO������Һ��pH������BΪFe(OH)3����3������������Ӧ����ʽ����֪��ҺX�к�������H2SO4����Ӧ���ɵ�MnSO4��Fe2(SO4)3������ҺX�е�������MnSO4��Fe2(SO4)3��H2SO4����������ʱʹ�õIJ��������в��������ƾ��ơ���4�����ݹ�ϵʽ��2S~2FeSO4~MnO2��n(MnO2)=![]() n(S)
n(S)![]() ��
��![]() =1.5 mol��n(MnSO4��H2O)=
=1.5 mol��n(MnSO4��H2O)=![]() =1.9 mol��������Ԫ���غ��֪n(MnO)=1.9 mol1.5 mol0.1 mol=0.3 mol�������������̿���MnO2��MnO�����ʵ���֮��Ϊ5��1��
=1.9 mol��������Ԫ���غ��֪n(MnO)=1.9 mol1.5 mol0.1 mol=0.3 mol�������������̿���MnO2��MnO�����ʵ���֮��Ϊ5��1��

����Ŀ��Ϊ��ǿ������ʴ��,����Ǧ����Ϊ���Դ,��Al��������Pb������,���ϡ����,ʹ�����������Ĥ����Ӧԭ������:
���:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
����:2Al+3H2O![]() Al2O3+3H2��
Al2O3+3H2��
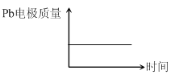
��������,�����ж���ȷ����( )
��� | ���� | |
A | H+����Pb�缫 | H+����Pb�缫 |
B | ÿ����3molPb | ����2molAl2O3 |
C | ����:PbO2+4H++2e-=Pb2++2H2O | ����:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D
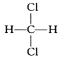
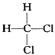
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ�ã������ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����

ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | MnO2 | Cl2 | NaOH��Һ |