题目内容
【题目】某小组选用下列装置,利用反应![]() ,通过测量生成水的质量
,通过测量生成水的质量![]() 来测定Cu的相对原子质量。实验中先称取氧化铜的质量
来测定Cu的相对原子质量。实验中先称取氧化铜的质量![]() 为a g。
为a g。
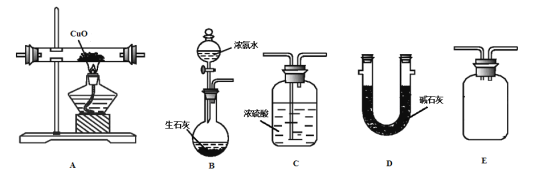
(1)浓氨水滴入生石灰中能制得NH3的原因是______________。
(2)甲同学按B-A-E-C-D的顺序连接装置,该方案是否可行__________,理由是_______________。
(3)乙同学按B-A-D-E-C的顺序连接装置,则装置C的作用是___________________________。
(4)丙同学认为乙同学测量的![]() 会偏高,理由是_____,你认为该如何改进?___
会偏高,理由是_____,你认为该如何改进?___
(5)若实验中测得![]() g,则Cu的相对原子质量为_______。(用含a,b的代数式表示)。
g,则Cu的相对原子质量为_______。(用含a,b的代数式表示)。
(6)若CuO中混有Cu,则该实验测定结果_________。(选填“偏大”、“偏小”或“不影响”)
【答案】氨水中存在平衡NH3+H2O![]() NH3 .H2O
NH3 .H2O ![]() NH4++OH-,生石灰吸收浓氨水中的水放出热量,生成OH-均能使平衡向左移动,从而得到氨气 不可行 C装置将生成的水和多余的氨气一起吸收,无法测量出生成水的质量 吸收未反应的NH3,防止空气中的水蒸气进入 装置B生成的氨气有混有水,故m(H2O)会偏高 可在装置B和A之间增加装置D
NH4++OH-,生石灰吸收浓氨水中的水放出热量,生成OH-均能使平衡向左移动,从而得到氨气 不可行 C装置将生成的水和多余的氨气一起吸收,无法测量出生成水的质量 吸收未反应的NH3,防止空气中的水蒸气进入 装置B生成的氨气有混有水,故m(H2O)会偏高 可在装置B和A之间增加装置D ![]() 偏大
偏大
【解析】
(1)生石灰和水反应生成Ca(OH)2且放出大量热,放出的热量导致溶液温度升高,抑制氨气溶解,氢氧根离子浓度增大抑制一水合氨电离;
(2)甲同学按B-A-E-C-D的顺序连接装置,过程中生成的水和过量氨气会被装置C吸收;
(3)乙同学按B-A-D-E-C的顺序连接装置,装置C可以吸收多余氨气和防止空气中水蒸气进入D影响测定结果;
(4)丙同学认为乙同学测量的m(H2O)会偏高,可能是氨气中水蒸气进入装置D被吸收,可以用碱石灰吸收水蒸气,干燥的氨气再和氧化铜反应;
(5)2NH3+3CuO=N2+3Cu+3H2O,结合化学方程式定量关系计算;
(6)若CuO中混有Cu,氧元素质量减小,测定水质量减小,结合计算定量关系判断结果误差。
(1)生石灰和水反应生成Ca(OH)2且放出大量热,放出的热量导致溶液温度升高,温度越高,导致氨气的溶解度越低;氢氧化钙电离生成氢氧根离子,氢氧根离子浓度增大抑制一水合氨电离,则抑制氨气溶解,所以常用氨水滴入生石灰中制取氨气,浓氨水滴入生石灰中能制得NH3的原因是:氨水中存在平衡NH3+H2ONH3H2ONH4++OH-,生石灰吸收浓氨水中的水放出热量,生成OH-均能使平衡向左移动,从而得到氨气;
答案是: 氨水中存在平衡NH3+H2O![]() NH3 .H2O
NH3 .H2O ![]() NH4++OH-,生石灰吸收浓氨水中的水放出热量,生成OH-均能使平衡向左移动,从而得到氨气;
NH4++OH-,生石灰吸收浓氨水中的水放出热量,生成OH-均能使平衡向左移动,从而得到氨气;
(2)甲同学按B-A-E-C-D的顺序连接装置,该方案不可行,C装置将生成的水和多余的氨气一起吸收,无法测量出生成水的质量;
答案是:不可行;C装置将生成的水和多余的氨气一起吸收,无法测量出生成水的质量;
(3)乙同学按B-A-D-E-C的顺序连接装置,则装置C的作用是:吸收未反应的NH3,防止空气中的水蒸气进入;
答案是: 吸收未反应的NH3,防止空气中的水蒸气进入;
(4)丙同学认为乙同学测量的m(H2O)会偏高,可能是装置B生成的氨气有混有水,故m(H2O)会偏高,可在装置B和A之间增加装置D吸收氨气中水蒸气,减少误差;
答案是:装置B生成的氨气有混有水,故m(H2O)会偏高;可在装置B和A之间增加装置D;
(5)反应2NH3+3CuO=N2+3Cu+3H2O,生成水物质的量和氧化铜物质的量相同,若实验中测得m(H2O)=bg,氧化铜物质的量n=![]() ,实验中先称取氧化铜的质量m[(CuO)]为a g,则Cu的摩尔质量=ag/[bg/18g/mol]-16g/mol,即Cu的相对原子质量为:
,实验中先称取氧化铜的质量m[(CuO)]为a g,则Cu的摩尔质量=ag/[bg/18g/mol]-16g/mol,即Cu的相对原子质量为:![]() -16;
-16;
答案是:![]() -16;
-16;
(6)若CuO中混有Cu,氧元素质量减小,测定水质量减小,b减小,则![]() -16值增大,所以若CuO中混有Cu,则该实验测定结果偏大;
-16值增大,所以若CuO中混有Cu,则该实验测定结果偏大;
答案是:偏大。