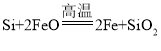题目内容
【题目】无机物可根据其组成和性质进行分类。现有Cl2、Na、CO2、Na2O、Na2O2、NH3六种物质,完成下列填空:
(1)由分子构成的单质是____________,属于极性分子的是____________。
(2)既有离子键又有共价键的物质的电子式为____________。
(3)上述化合物中组成元素的原子半径由大到小的顺序是____________。
(4)根据与水反应的不同,上述物质可分成A组(CO2、Na2O和NH3)和B组(Cl2、Na和Na2O2),分组的依据是________________________。
(5)在酸性高锰酸钾溶液中加入Na2O2,溶液褪色,发生反应![]() (未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
(未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
【答案】Cl2 NH3 ![]() Na>C>N>O>H 与水反应是否是氧化还原反应
Na>C>N>O>H 与水反应是否是氧化还原反应 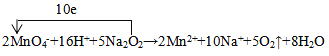
【解析】
(1)单质分子只有一种元素构成,极性分子的正负电荷重心不重叠;
(2)既有离子键又有共价键的物质只有过氧化钠;
(3)上述化合物中组成元素有H、C、N、O、Na,结合原子半径的递变规律判断;
(4)两组反应的区别为是否为氧化还原反应;
(5)反应中Mn元素化合价降低5价,O元素化合价升高1价,化合价升高值=化合价降低值=转移电子数。
(1)由分子构成的单质是Cl2,属于极性分子的是NH3;
答案是:Cl2; NH3;
(2)既有离子键又有共价键的物质为过氧化钠,电子式为![]() ;
;
答案是:![]() ;
;
(3)上述化合物中组成元素有H、C、N、O、Na,由同周期元素从左到右原子半径逐渐减小,同主族从上到下逐渐增大可以知道原子半径大小顺序为Na> C> N> O>H;
答案是:Na>C>N>O>H;
(4)两组反应的区别为与水反应是否是为氧化还原反应;
答案是:与水反应是否是氧化还原反应;
(5)在2MnO4-+12H++5Na2O2=2Mn2++5O2+8H2O+10Na+中,2MnO4-→2Mn2+,Mn元素的化合价由+7价→+2价,得到2×5e-,Mn元素的化合价降低其所在的物质高锰酸钾是氧化剂;5Na2O2→5O2,O元素的化合价由-1价→0价,失去10e-,电子转移情况如下: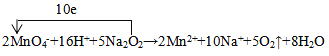 ;
;
答案是: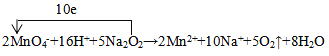 。
。