题目内容
(2010?德阳模拟)浓盐酸与重铬酸钾(K2Cr2O7)共热时产生某种气体单质X和三氯化铬(CrCl3)等,这种方法制取X时便于控制反应.实验室制得纯净、干燥的X装置如图I所示.
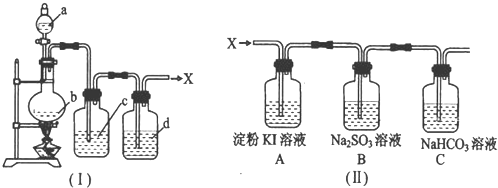
请回答下列问题:
(1)加热时,a与b反应的化学方程式是
(2)液体c的作用是
(3)现把制得的X持续通入图II所示的装置中进行性质实验.①A装置中可能出现的现象是
(4)向装有一定量的重铬酸钾(K2Cr2O7)的圆底烧瓶中加入一定量的浓盐酸,为了提高浓盐酸的利用率可以采取的措施是
(5)若设计一个简单实验,证明B装置中的Na2SO3已被氧化,则实验操作及现象是

请回答下列问题:
(1)加热时,a与b反应的化学方程式是
K2Cr2O7+14HCl
2CrCl3+3Cl2↑+2KCl+7H2O
| ||
K2Cr2O7+14HCl
2CrCl3+3Cl2↑+2KCl+7H2O
.
| ||
(2)液体c的作用是
除去氯气中的氯化氢气体
除去氯气中的氯化氢气体
.(3)现把制得的X持续通入图II所示的装置中进行性质实验.①A装置中可能出现的现象是
变蓝色
变蓝色
.②C装置中发生反应的离子方程式是Cl2+HCO3-=Cl-+HClO+CO2↑
Cl2+HCO3-=Cl-+HClO+CO2↑
.(4)向装有一定量的重铬酸钾(K2Cr2O7)的圆底烧瓶中加入一定量的浓盐酸,为了提高浓盐酸的利用率可以采取的措施是
小火加热,并多次少量地向烧瓶中加入浓盐酸
小火加热,并多次少量地向烧瓶中加入浓盐酸
.(5)若设计一个简单实验,证明B装置中的Na2SO3已被氧化,则实验操作及现象是
取反应后B中容易少许,加入足量的盐酸酸化,再加入氯化钡溶液,有白色沉淀生成,则说明亚硫酸钠已被氧化
取反应后B中容易少许,加入足量的盐酸酸化,再加入氯化钡溶液,有白色沉淀生成,则说明亚硫酸钠已被氧化
.分析:(1)浓盐酸与重铬酸钾(K2Cr2O7)共热时产生某种气体单质X为Cl2和三氯化铬(CrCl3),依据原子守恒分析配平化学方程式;
(2)氯气中含有氯化氢和水蒸气,装置(1)c中是利用饱和氯化钠溶液除去氯化氢气体;
(3)①氯气通过淀粉碘化钾溶液,氯气氧化碘离子为碘单质,遇到淀粉变蓝;
②氯气和水反应生成氯化氢和次氯酸,盐酸和碳酸氢钠反应生成二氧化碳,次氯酸酸性弱不能和碳酸氢钠反应,分析写出离子方程式;
(4)提高浓盐酸的利用率,减少氯化氢挥发,可以多次加入,小火加热等措施减少氯化氢的挥发;
(5)亚硫酸钠被氧化为硫酸钠,溶解后加入盐酸排除其他离子干扰,加入氯化钡溶液检验硫酸根离子的存在设计实验验证.
(2)氯气中含有氯化氢和水蒸气,装置(1)c中是利用饱和氯化钠溶液除去氯化氢气体;
(3)①氯气通过淀粉碘化钾溶液,氯气氧化碘离子为碘单质,遇到淀粉变蓝;
②氯气和水反应生成氯化氢和次氯酸,盐酸和碳酸氢钠反应生成二氧化碳,次氯酸酸性弱不能和碳酸氢钠反应,分析写出离子方程式;
(4)提高浓盐酸的利用率,减少氯化氢挥发,可以多次加入,小火加热等措施减少氯化氢的挥发;
(5)亚硫酸钠被氧化为硫酸钠,溶解后加入盐酸排除其他离子干扰,加入氯化钡溶液检验硫酸根离子的存在设计实验验证.
解答:解:(1)浓盐酸与重铬酸钾(K2Cr2O7)共热时产生某种气体单质X为Cl2和三氯化铬(CrCl3),依据原子守恒写出的化学方程式为:K2Cr2O7+14HCl
2CrCl3+3Cl2↑+2KCl+7H2O;
故答案为:K2Cr2O7+14HCl
2CrCl3+3Cl2↑+2KCl+7H2O;
(2)氯气中含有氯化氢和水蒸气,装置(1)c中是利用饱和氯化钠溶液除去氯化氢气体,d装置利用浓硫酸除去水蒸气;
故答案为:除去氯气中的氯化氢气体;
(3)①生成的氯气通过淀粉碘化钾溶液发生反应,Cl2+2I-=I2+2Cl-,碘单质遇淀粉变蓝色;
故答案为:变蓝色;
②C装置中发生的氯气和水反应生成氯化氢和次氯酸,盐酸和碳酸氢钠反应生成二氧化碳,次氯酸酸性弱不能和碳酸氢钠反应,反应的离子方程式为:Cl2+HCO3-=Cl-+HClO+CO2↑;
故答案为:Cl2+HCO3-=Cl-+HClO+CO2↑;
(4)为了提高浓盐酸的利用率可以采取的措施是提高浓盐酸的利用率,减少氯化氢挥发,可以多次加入,小火加热等措施减少氯化氢的挥发;
故答案为:小火加热,并多次少量地向烧瓶中加入浓盐酸;
(5)亚硫酸钠被氧化为硫酸钠,溶解后加入盐酸排除其他离子干扰,加入氯化钡溶液检验硫酸根离子的存在,实验步骤是,应后B中容易少许,加入足量的盐酸酸化,再加入氯化钡溶液,有白色沉淀生成,则说明亚硫酸钠已被氧化;
故答案为:应后B中容易少许,加入足量的盐酸酸化,再加入氯化钡溶液,有白色沉淀生成,则说明亚硫酸钠已被氧化;
| ||
故答案为:K2Cr2O7+14HCl
| ||
(2)氯气中含有氯化氢和水蒸气,装置(1)c中是利用饱和氯化钠溶液除去氯化氢气体,d装置利用浓硫酸除去水蒸气;
故答案为:除去氯气中的氯化氢气体;
(3)①生成的氯气通过淀粉碘化钾溶液发生反应,Cl2+2I-=I2+2Cl-,碘单质遇淀粉变蓝色;
故答案为:变蓝色;
②C装置中发生的氯气和水反应生成氯化氢和次氯酸,盐酸和碳酸氢钠反应生成二氧化碳,次氯酸酸性弱不能和碳酸氢钠反应,反应的离子方程式为:Cl2+HCO3-=Cl-+HClO+CO2↑;
故答案为:Cl2+HCO3-=Cl-+HClO+CO2↑;
(4)为了提高浓盐酸的利用率可以采取的措施是提高浓盐酸的利用率,减少氯化氢挥发,可以多次加入,小火加热等措施减少氯化氢的挥发;
故答案为:小火加热,并多次少量地向烧瓶中加入浓盐酸;
(5)亚硫酸钠被氧化为硫酸钠,溶解后加入盐酸排除其他离子干扰,加入氯化钡溶液检验硫酸根离子的存在,实验步骤是,应后B中容易少许,加入足量的盐酸酸化,再加入氯化钡溶液,有白色沉淀生成,则说明亚硫酸钠已被氧化;
故答案为:应后B中容易少许,加入足量的盐酸酸化,再加入氯化钡溶液,有白色沉淀生成,则说明亚硫酸钠已被氧化;
点评:本题考查了实验室制备氯气原理的分析应用,氯气性质的分析判断,实验过程特征的理解应用,离子检验的实验方法,题目难度中等.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目