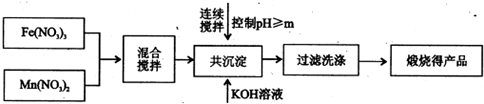
题目内容
(2010?德阳模拟)下列离子方程式正确的是( )
分析:A.过氧化钠在离子反应中保留化学式;
B.碳酸氢镁完全反应,反应生成氢氧化镁、碳酸钙、水;
C.至SO42-恰好完全沉淀,二者以1:2反应,生成硫酸钡、偏铝酸钾、水;
D.碱性溶液中生成水,不生成氢离子.
B.碳酸氢镁完全反应,反应生成氢氧化镁、碳酸钙、水;
C.至SO42-恰好完全沉淀,二者以1:2反应,生成硫酸钡、偏铝酸钾、水;
D.碱性溶液中生成水,不生成氢离子.
解答:解:A.过氧化钠与水反应的离子反应为2Na2O2+2H2O=O2↑+4Na++4OH-,故A错误;
B.向碳酸氢镁溶液中加入过量的澄清石灰水的离子反应为Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,故B正确;
C.向明矾[KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀的离子反应为Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O,故C错误;
D.次氯酸钠与Fe(OH)3在碱性溶液中反应生成Na2FeO4的离子反应为4OH-+3ClO-+2Fe(OH)3=2FeO42-+5H2O+3Cl-,故D错误;
故选B.
B.向碳酸氢镁溶液中加入过量的澄清石灰水的离子反应为Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,故B正确;
C.向明矾[KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀的离子反应为Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O,故C错误;
D.次氯酸钠与Fe(OH)3在碱性溶液中反应生成Na2FeO4的离子反应为4OH-+3ClO-+2Fe(OH)3=2FeO42-+5H2O+3Cl-,故D错误;
故选B.
点评:本题考查离子反应方程式的书写,为高考常见题型,把握发生的化学反应为解答的关键,涉及与量有关的离子反应及氧化还原反应等知识点,注意选项D为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目