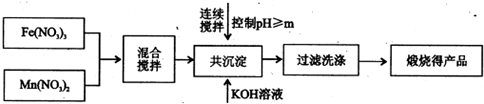
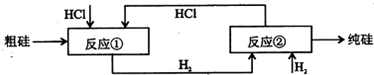
题目内容
(2010?德阳模拟)下列事实能用同一原理解释的是( )
分析:A.胶体遇电解质发生聚沉;
B.二氧化硫与氯气发生氧化还原反应,与氨水发生中和反应;
C.蛋白质可发生盐析和变性;
D.明矾和硫酸铁都可水解生成具有吸附性的胶体.
B.二氧化硫与氯气发生氧化还原反应,与氨水发生中和反应;
C.蛋白质可发生盐析和变性;
D.明矾和硫酸铁都可水解生成具有吸附性的胶体.
解答:解:A.向硝酸银溶液和新制的Fe(OH)3胶体中分别加入少量稀盐酸,硝酸银与盐酸反应生成氯化银沉淀,胶体遇电解质发生聚沉,原理不同,故A不选;
B.二氧化硫与氯气发生氧化还原反应,与氨水发生中和反应,原理不同,故B不选;
C.向蛋白质溶液中加入饱和硫酸铵溶液或乙酸铅溶液,都产生白色沉淀,分别发生盐析和变性,原理不同,故C不选;
D.明矾和硫酸铁都可水解生成具有吸附性的胶体,可用于净水,故D选.
故选D.
B.二氧化硫与氯气发生氧化还原反应,与氨水发生中和反应,原理不同,故B不选;
C.向蛋白质溶液中加入饱和硫酸铵溶液或乙酸铅溶液,都产生白色沉淀,分别发生盐析和变性,原理不同,故C不选;
D.明矾和硫酸铁都可水解生成具有吸附性的胶体,可用于净水,故D选.
故选D.
点评:本题考查较为综合,涉及胶体的性质、二氧化硫的性质以及盐类的水解等知识,侧重于学生的分析能力和双基的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目