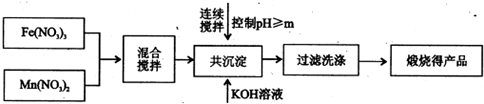
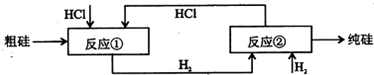
题目内容
(2010?德阳模拟)X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期.X原子最外层电子数是其电子层数的3倍.Z原子的核外电子数比X原子少1.M是同周期中原子半径最大的元素(除稀有气体元素外).下列说法正确的是( )
分析:X、Y、Z、M是4种短周期元素,X原子最外层电子数是其电子层数的3倍,X原子有2个电子层,最外层电子数为6,则X为O元素;X、Y位于同一主族,则Y为S元素;Z原子的核外电子数比X原子少1,可知Z是N元素;Y与M同一周期,且M是同周期中半径最大的元素,应处于ⅠA族元素,则M为Na元素,根据元素所在周期表中的位置结合元素周期律的递变性和相似性解答该题.
解答:解:X、Y、Z、M是4种短周期元素,X原子最外层电子数是其电子层数的3倍,X原子有2个电子层,最外层电子数为6,则X为O元素;X、Y位于同一主族,则Y为S元素;Z原子的核外电子数比X原子少1,可知Z是N元素;Y与M同一周期,且M是同周期中半径最大的元素,应处于ⅠA族元素,则M为Na元素,
A.N与O元素可以形成N2O、NO、N2O3、NO2、N2O4、N2O5,故A错误;
B.SO2中S原子价层电子对数=2+
=3,S原子有1对孤对电子,为V型结构,分子中正负电荷重心不重合,为极性分子,SO3中S原子价层电子对数=3+
=3,S原子没有孤对电子,为平面正三角形,分子中正负电荷重心重合,为非极性分子,故B错误;
C.X为O元素,对应的氢化物中含有氢键,常温下为液体,而氨气、氯化氢为气态,故水的沸点最高,故C错误;
D.离子的核外电子层数越多半径越大,S2-半径最大,Na+、O2-、N3-核外电子排布相同,核电核数越大,离子半径越小,则有四种元素简单离子的半径由大到小依次为Y>Z>X>M,故D正确,
故选D.
A.N与O元素可以形成N2O、NO、N2O3、NO2、N2O4、N2O5,故A错误;
B.SO2中S原子价层电子对数=2+
| 6-2×2 |
| 2 |
| 6-3×2 |
| 2 |
C.X为O元素,对应的氢化物中含有氢键,常温下为液体,而氨气、氯化氢为气态,故水的沸点最高,故C错误;
D.离子的核外电子层数越多半径越大,S2-半径最大,Na+、O2-、N3-核外电子排布相同,核电核数越大,离子半径越小,则有四种元素简单离子的半径由大到小依次为Y>Z>X>M,故D正确,
故选D.
点评:本题考查元素位置结构性质的相互关系及应用,题目难度中等,正确推断元素的种类为解答该题的关键,A选项为易错点,学生容易根据化合价判断忽略四氧化二氮.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目