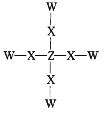题目内容
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下。
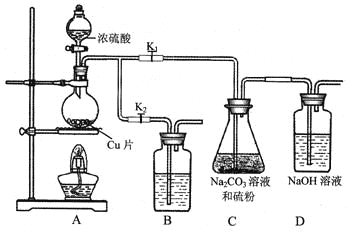
I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
当C中溶液的pH接近7时即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①I中,圆底烧瓶中发生反应的化学方程式是_________。
②II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是__________。
“停止C中的反应”的操作是___________。
③III中,“过滤”用到的玻璃仪器是(填仪器名称)___________。
④装置B中盛放的试剂是(填化学式)________溶液,其作用是__________。
(2)依据反应2S2O32-+I2=S4O2-6+2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品,配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/LI2的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 | 4 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
①判断达到滴定终点的现象是______________。
②Na2S2O3·5H2O在产品中的质量分数是(计算结果保留1位小数)_________。
(Na2S2O3·5H2O的式量为248)
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O Na2S2O3在酸性溶液中不能稳定存在 打开K2,关闭K1 漏斗、玻璃棒、烧杯 NaOH 在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染 加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变 90.2%
CuSO4+SO2↑+2H2O Na2S2O3在酸性溶液中不能稳定存在 打开K2,关闭K1 漏斗、玻璃棒、烧杯 NaOH 在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染 加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变 90.2%
【解析】
(1)浓硫酸具有强氧化性,在加热的条件下能氧化单质铜,反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
生成的SO2和碳酸钠反应生成亚硫酸钠和CO2,由于Na2S2O3在酸性溶液中不能稳定存在,所以C中碳酸钠的作用是起反应物作用及提供碱性环境。“停止C中的反应”的操作是打开K2,关闭K1;
(2)过滤时的主要玻璃仪器有漏斗、烧杯、玻璃棒;
SO2是大气污染物,需要尾气处理,则装置B中盛放的试剂是氢氧化钠溶液,用来吸收SO2,防止污染环境;
(3)由于碘遇淀粉显蓝色,则滴定时,达到滴定终点的现象是溶液变蓝,且半分钟不改变。根据表中数据可知,第二次实验中消耗I2标准溶液的体积偏小,舍去,则实际消耗I2标准溶液的体积的平均值是![]() ,则根据反应的方程式可知,Na2S2O3·5H2O的物质的量是0.050mol/L×0.0200L×2×10=0.02mol,所以Na2S2O3·5H2O在产品中的质量分数是
,则根据反应的方程式可知,Na2S2O3·5H2O的物质的量是0.050mol/L×0.0200L×2×10=0.02mol,所以Na2S2O3·5H2O在产品中的质量分数是![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)镁的原子结构示意图为___。
(2)H2SO4与HClO4中,酸性较强的是___。
(3)NaOH与Al(OH)3中,属于两性氢氧化物的是___。它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为___。