题目内容
【题目】短周期主族元素 W、X、Y、Z位于三个不同的周期,W与Y同主族,X 与 Z 的核外电子数之和是Y的核外电子数的2倍。化合物甲的结构式如图所示,甲不溶于水。下列说法正确的是( )
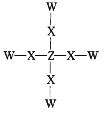
A.简单离子半径:Y>X
B.非金属性:Z>X
C.化合物甲中每个原子都达到了8电子稳定结构
D.由 W、X、Y 三种元素形成的化合物的水溶液能与 Z 的单质反应
【答案】D
【解析】
X 与 Z 的核外电子数之和是Y的核外电子数的2倍,X为O,Z为Si,Y为Na,短周期主族元素 W、X、Y、Z位于三个不同的周期,则W为H,甲为H4SiO4。
A.核外电子排布相同的离子,核电荷数越大,离子半径越小; 简单离子半径:r (O) > r (Na),A错误;
B. 原子半径:O > Si,所以非金属性:O > Si,B错误;
C.化合物甲为H4SiO4,氢原子达不到8电子稳定结构,C错误;
D. 由 H、O、Na 三种元素形成的化合物为NaOH,NaOH水溶液能与Si单质反应,D正确;
故答案选D。

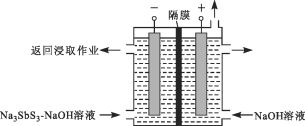
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下。
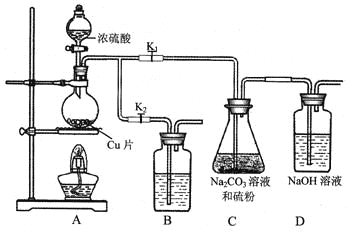
I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
当C中溶液的pH接近7时即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①I中,圆底烧瓶中发生反应的化学方程式是_________。
②II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是__________。
“停止C中的反应”的操作是___________。
③III中,“过滤”用到的玻璃仪器是(填仪器名称)___________。
④装置B中盛放的试剂是(填化学式)________溶液,其作用是__________。
(2)依据反应2S2O32-+I2=S4O2-6+2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品,配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/LI2的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 | 4 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
①判断达到滴定终点的现象是______________。
②Na2S2O3·5H2O在产品中的质量分数是(计算结果保留1位小数)_________。
(Na2S2O3·5H2O的式量为248)