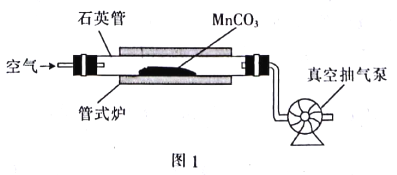
题目内容
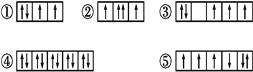
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是___,违反了洪特规则的是___。
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为___;其最高价氧化物对应水化物的化学式是___。
【答案】 ② ③⑤ 1s22s22p63s23p4 H2SO4
【解析】(1)泡利原理为:在原子中不能容纳运动状态完全相同的电子。所以在②的中间轨道上有两个自旋方向相同的电子,其运动状态完全相同,违反了泡利原理。洪特规则为:在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同。所以③中5个电子应该以自旋方向相同的方式分别占据5个轨道,⑤中前四个单电子应该自旋方向相同,都违反了洪特规则。
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,该元素原子核外有16个电子,为S元素,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p4;其最高价氧化物对应水化物是硫酸,化学式为H2SO4。

练习册系列答案
相关题目
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 50mL 1 mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中c(OH-) /c(HCO3-) 增大 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D