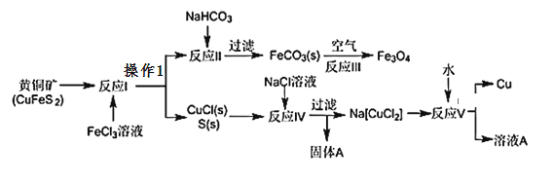
题目内容
【题目】(1)5 mol的CO2与8 mol的SO2的分子数之比是________;原子数之比是________;质量比是________。
(2)KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:________KClO3+________HCl(浓)===________KCl+________ClO2↑+________Cl2↑+________H2O
①配平以上化学方程式(化学计量数填入划线上)。
②ClO2是反应的________(填“氧化”或“还原”)产物。浓盐酸在反应中显示出来的性质是(填写号码)________。
a.还原性 b.氧化性 c.酸性 d.碱性
③反应产生0.1 mol Cl2,则转移的电子的物质的量为________ mol。
④ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的________倍(保留2位小数)。
【答案】5∶85∶855∶1282 4 2 2 1 2还原ac0.22.63
【解析】
(1)5molCO2与8mol SO2的分子数之比等于物质的量之比,即5:8,二者都是三原子分子,所以原子数之比是5:8,质量之比是(5×44):(8×64)=55:128;
(2)①KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合元素守恒可知水的系数是2;
②KClO3氯元素的化合价降低,是氧化剂,对应的产物二氧化氯是还原产物;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高,氯元素被氧化,浓盐酸中Cl元素的化合价部分升高,部分转化为盐酸盐中,化合价不变,所以盐酸在反应中显示出来的性质是酸性和还原性,答案选ac;
③反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol;
④设质量都是71g,氯气是1mol,得到的电子为2mol,ClO2得到的电子为![]() ,则ClO2消毒的效率是Cl2的倍数为5.26÷2=2.63。
,则ClO2消毒的效率是Cl2的倍数为5.26÷2=2.63。

 精英口算卡系列答案
精英口算卡系列答案【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 50mL 1 mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中c(OH-) /c(HCO3-) 增大 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D