题目内容
将等物质的量的F2和ClF混合,在密闭容器中发生反应:F2(g)+ClF(g) 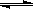 ClF3(g) ΔH<0。下列叙述正确的是
ClF3(g) ΔH<0。下列叙述正确的是
| A.保持恒容,平衡后再降低温度,平衡常数减小 |
| B.若增加F2的用量,平衡正向移动,则反应物的转化率均增大 |
| C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移 |
| D.恒温恒容时,当ClF转化40%时,容器内的压强为初始时的0.8 |
D
解析试题分析:A、正方应是放热反应,则保持恒容,平衡后再降低温度,平衡向正反应方向移动,因此平衡常数增大,A不正确;B、若增加F2的用量,平衡正向移动,ClF的转化率增大,但单质氟的转化率降低,B不正确;C、正方应是体积减小的可逆反应,达到平衡后,若增大容器体积,越强降低,则正反应速率和逆反应均减小,平衡左移,C不正确;D、恒温恒容时,当ClF转化40%时,则
F2(g)+ClF(g) 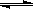 ClF3(g)
ClF3(g)
起始量(mol) n n 0
转化量(mol) 0.4n 0.4n 0.4n
平衡量(mol) 0.6n 0.6n 0.4n
所以容器内的压强为初始时的 =0.8倍,D正确,答案选D。
=0.8倍,D正确,答案选D。
考点:考查外界条件对反应速率和平衡状态的影响以及可逆反应的有关计算

在100 ℃时,把0.5 mol N2O4通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是 ( )
| A.前2 s以N2O4的浓度变化表示的反应速率为0.01 mol·L-1·s-1 |
| B.在2 s时体系内的压强为开始时的1.1倍 |
| C.在平衡时体系内含N2O4 0.25 mol |
| D.平衡时,N2O4的转化率为40% |
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO3为0.4mol/L |
| C.SO2、S03均为0.15mol/L | D.SO2为0.25mol/L |
把下列4种X的溶液分别加入4个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时X和盐酸缓和地进行反应。其中反应速率最大的是
| A.20mL3mol·L-1的X溶液 | B.20mL2mol·L-1的X溶液 |
| C.10mL4mol·L-1的X溶液 | D.10mL2mol·L-1的X溶液 |
下列有关化学反应速率的说法正确的是
| A.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 |
| B.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
| C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 |
| D.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
在2升的密闭容器中,反应物的物质的量为3mol,经过20s后,它的物质的量变成了1mol,在这20s内它的反应速率为 ( )
| A.0.1 mol / (L·S) | B.0.05mol /( L·min) |
| C.0.05mol / (L·S) | D.0.8mol / (L·S) |
下列事实中,不能用勒夏特列原理解释的是
| A.密闭、低温是存放氨水的必要条件 |
| B.实验室常用排饱和食盐水法收集氯气 |
| C.硝酸工业生产中,使用过量空气以提高NH3的利用率 |
| D.合成氨反应采用较高温度和使用催化剂,以提高氨气的产量 |
已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g) N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是
N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是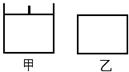
| A.平衡时NO2体积分数:甲<乙 |
| B.达到平衡所需时间,甲与乙相等 |
| C.该反应的平衡常数表达式K=c(N2O4)/c(NO2) |
| D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态 |
下列情况下的反应一定能自发进行的是
| A.ΔH>0 ΔS<0 | B.ΔH>0 ΔS>0 |
| C.ΔH<0 ΔS<0 | D.ΔH<0 ΔS>0 |