题目内容
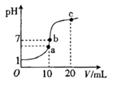
25℃时,2a mol·L-1HA水溶液中(HA为弱酸)。用NaOH调节溶液pH(忽略体积变化),得到c(HA)、c(A-)与溶液pH的变化关系如下图所示。下列说法错误的是

A.当pH=3时,溶液中c(A-)>c(Na+)
B.当c(A-)>c(HA),溶液一定呈碱性
C.当pH=3.45时,c(Na+)+c(H+)=c(HA)+c(OH-)
D.当pH=4时,溶液中:c(HA)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1

A.当pH=3时,溶液中c(A-)>c(Na+)
B.当c(A-)>c(HA),溶液一定呈碱性
C.当pH=3.45时,c(Na+)+c(H+)=c(HA)+c(OH-)
D.当pH=4时,溶液中:c(HA)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1
B
试题分析:A、当pH=3时,c(OH-)< c(H+)且溶液中存在电荷守恒:c(OH-)+c(A-)=c(Na+) +c(H+),所以溶液中c(A-)>c(Na+),正确;B、根据图像pH>3.45时,c(A-)>c(HA),溶液不一定呈碱性,错误;C、当pH=3.45时,c(A-)=c(HA)且c(OH-)+c(A-)=c(Na+) +c(H+),可得c(Na+)+c(H+)=c(HA)+c(OH-),正确;D、c(Na+)+c(H+)-c(OH-)=c(A-)="1.6a" mol·L-1,c(HA)="0.4a" mol·L-1,所以c(HA)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1,正确。

练习册系列答案
相关题目
 NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)
NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)
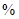 Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
 Cu(OH) 2+2H+的平衡常数K=_______。
Cu(OH) 2+2H+的平衡常数K=_______。