题目内容
下列说法正确的是( )
| A.pH=2和pH=1的硝酸中c(H+)之比为1:10 |
| B.0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1 |
| C.室温时,0.1mol/L 某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 |
| D.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH- 数目为0.2NA |
AC
试题分析:硝酸为强酸,所以pH=2和pH=1的硝酸中c(H+)之比为1:10,故A正确,醋酸为弱酸,所以0.2 mol/L与0.1 mol/L醋酸中c(H+)之比不为2:1,故B错误;室温时,0.1mol/L 某一元酸HA在水中有0.1%发生电离,即c(H+)=0.1×0.1%=0.0001,所以pH=-lgc(H+)=4,故C正确;pH=13的1.0 L Ba(OH)2溶液中含有的OH- 数目为0.1NA ,故D错误,所以本题的答案选择AC。
点评:本题考查了强弱酸、碱的基础知识,属于对基础知识的考查,本题难度不大。

练习册系列答案
相关题目
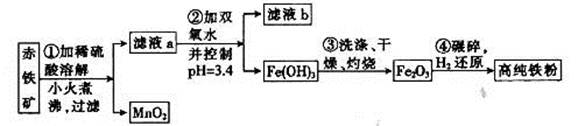
 Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
 Cu(OH) 2+2H+的平衡常数K=_______。
Cu(OH) 2+2H+的平衡常数K=_______。
 H++OH-向右移动,且使溶液呈酸性的是( )
H++OH-向右移动,且使溶液呈酸性的是( )