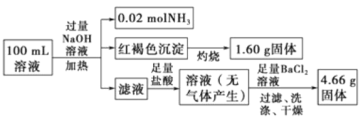
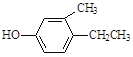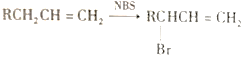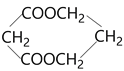题目内容
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
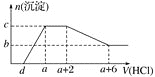
、![]() 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸的体积变化如图所示。下列说法正确的是
等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸的体积变化如图所示。下列说法正确的是![]()
A.原溶液中可能含有![]() 、可能不含有
、可能不含有![]()
B.原溶液中一定含有的阴离子只有:![]() 、
、![]() 、
、![]()
C.原溶液中含![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]()
D.![]()
【答案】C
【解析】
由图象分析可知,开始无沉淀生成说明加入的盐酸和溶液中的碱反应,说明溶液中一定含OH-离子,则与氢氧根离子不能共存的离子为Fe3+、Mg2+、Al3+;随后反应生成沉淀逐渐增大,说明是AlO2-、SiO32-和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,由于AlO2-与HCO3-发生反应生成氢氧化铝沉淀,则溶液中一定不存在HCO3-;继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中一定含有Na+离子;
A、溶液中硫酸根离子不能确定,剩余原溶液不一定含有Na2SO4,故A错误;
B、依据判断原溶液中一定含有的阴离子是:OH-、SiO32-、AlO2-、CO32-,故B错误;
C、依据图象可知和碳酸根离子反应的盐酸为2体积,CO32-+2H+=CO2↑+H2O 氢氧化铝溶解消耗的盐酸体积为4体积,Al(OH)3+3H+=Al3++3H2O,原溶液中含有CO32-与AlO2-的物质的量之比为3:4,故C正确;
D、溶液含有的阴离子是:OH-、SiO32-、AlO2-、CO32-,向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,先是和氢氧根之间中和反应,不会出现沉淀,然后是SiO32-、AlO2-和氢离子之间的沉淀反应,据图示知道,氢氧化铝完全溶解消耗盐酸是4,所以氢氧化铝是![]() ,所以产生这些氢氧化铝沉淀就需要消耗氢离子是
,所以产生这些氢氧化铝沉淀就需要消耗氢离子是![]() ,再加上产生硅酸沉淀消耗的氢离子,所以a-d>
,再加上产生硅酸沉淀消耗的氢离子,所以a-d>![]() ,故D错误。
,故D错误。
故选:C。

 全能练考卷系列答案
全能练考卷系列答案【题目】现有五种有机物,请回答下列问题:
A. | B. | C. |
D.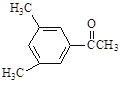 E.
E.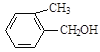 F.
F.![]()
(1)A物质中含有的官能团名称为_____________、______________。
(2)B的分子式为_________________。
(3)D的一氯代物最多有________________种。
(4)上述化合物中互为同分异构体的是_____;互为同系物的是____。(填字母)