题目内容
【题目】25℃时,向25mL 0.1000mo1·L-1 HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示。下列有关叙述错误的是
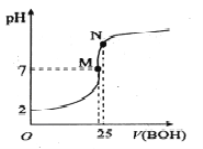
A. BA溶液呈碱性
B. 酸HA的电离常数约为0.0011
C. M点时c(B+)=c(A-)> c(H+)= c(OH-)
D. N点时加入10mL0.1mol/L HA溶液,将促进A-的水解
【答案】D
【解析】A.根据图像可知,加入等体积、等浓度的BOH溶液时,二者恰好反应生成BA,此时溶液的pH>7,说明BA溶液呈碱性,故A正确;B.根据图像可知0.1000molL-1HA溶液的pH=2,则c(A-)≈c(H+)=1×10-2mol/L,c(HA)=0.1000molL-1-0.01mol/L=0.090mol/L,酸HA的电离常数为:Ka=![]() =0.0011,故B正确;C.M点溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可知:c(B+)=c(A-),溶液中离子浓度大小为:c(B+)=c(A-)>c(H+)=c(OH-),故C正确;D.加入10mL0.1000molL-1HA溶液后,HA的浓度增大,抑制了A-的水解,故D错误;故选D。
=0.0011,故B正确;C.M点溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可知:c(B+)=c(A-),溶液中离子浓度大小为:c(B+)=c(A-)>c(H+)=c(OH-),故C正确;D.加入10mL0.1000molL-1HA溶液后,HA的浓度增大,抑制了A-的水解,故D错误;故选D。

【题目】自来水中氯离子的测定对人体健康有重要意义,实验室常用莫尔法测定水体中氯离子含量。实验过程如下:向水样中加入K2CrO4 (黄色) 溶液作指示剂,用AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。
回答下列问题:
(1)滴定时,应使用____________(填“酸式”或“碱式”) 滴定管,原因是_______________________。
(2)水样应调至中性或弱碱性,强酸性时加入K2CrO4溶液发生反应的离子方程式是___________________________________________。
(3)滴定达到终点的标志是___________________________________________。
(4)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
c(AgNO3)/ mol·L-1 | 0.0010 | ||
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
计算水样中氯离子的含量为_______________mg/L(保留2位小数)
(5)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________。
②已知2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
(6)下列情况会造成实验测定结果偏低的是____________。(填标号)
A.锥形瓶洗涤后未干燥
B.滴定前,未使用标准液润洗滴定管
C.酸式滴定管滴定前仰视读数,滴定后俯视读数
D.酸式滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡