题目内容
【题目】按要求对下图中两极进行必要的联接并填空:
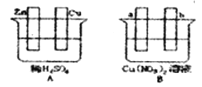
(1)在A图中,使铜片上冒H2气泡。请加以必要联接①______(在答题卡的图中画线),则联接后的装置叫②______。电极反应式:锌板:③_______;铜板:④_______。
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出①______。加以必要的联接后,该装置叫②_____。电极反应式:a极:③_______b极:④___________。经过一段时间后,停止反应并搅均溶液,溶液的pH值⑤______(升高、降低、不变),加入一定量的⑥_____后,溶液能恢复至与电解前完全一致。
【答案】 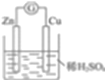 原电池 Zn-2e- =Zn2+ 2H+ +2e-=H2↑ O2 电解池 Cu2++2e- =Cu 4OH--4e-=O2↑+2H2O 降低 CuO或者CuCO3
原电池 Zn-2e- =Zn2+ 2H+ +2e-=H2↑ O2 电解池 Cu2++2e- =Cu 4OH--4e-=O2↑+2H2O 降低 CuO或者CuCO3
【解析】(1)(1)在A图中,使铜片上冒H2气泡,说明氢离子在铜片得到电子,需要将锌铜之间连接导线,构成原电池,如图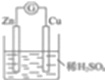 ;负极反应式为:Zn-2e- =Zn2+,正极反应为:2H+ +2e-=H2↑;(2)在B图中(a、b均为惰性电极),使a极析出铜,说明铜离子要在a电极上得到电子,a电极要与外电源的负极相连,b电极与外电源的正极相连,连接后的装置叫电解池,水(水的氢氧根离子)在b电极上失去电子生成氧气,电极反应式:a极:Cu2++2e- =Cu ,b极:4OH--4e-=O2↑+2H2O,经过一段时间后,停止反应并搅均溶液,溶液中氢离子浓度增大,pH值降低,加入一定量的CuO或者CuCO3后,溶液能恢复至与电解前完全一致。
;负极反应式为:Zn-2e- =Zn2+,正极反应为:2H+ +2e-=H2↑;(2)在B图中(a、b均为惰性电极),使a极析出铜,说明铜离子要在a电极上得到电子,a电极要与外电源的负极相连,b电极与外电源的正极相连,连接后的装置叫电解池,水(水的氢氧根离子)在b电极上失去电子生成氧气,电极反应式:a极:Cu2++2e- =Cu ,b极:4OH--4e-=O2↑+2H2O,经过一段时间后,停止反应并搅均溶液,溶液中氢离子浓度增大,pH值降低,加入一定量的CuO或者CuCO3后,溶液能恢复至与电解前完全一致。

 阅读快车系列答案
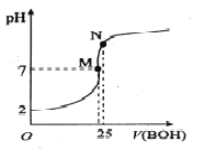
阅读快车系列答案【题目】某些物质的有关数据如下表,回答以下问题:
熔点(℃) | 沸点(℃) | 水溶性 | Ka1 | Ka2 | |||
乙醇 | -114.1 | 78.3 | 易溶 | 乙醇 | 2.6×10-16 | ||
乙醛 | -121 | 20.8 | 易溶 | H2SO3 | 1.23×10-2 | 5.6×10-8 | |
乙酸乙酯 | -83 | 77.0 | 难容 | H2CO3 | 4.2×10-7 | 5.6×10-11 |
实验一 乙醇在铜的催化下转化为乙醛
将一束质量为w的铜丝灼烧变黑后,迅速插入装有乙醇的试管a中。
(1)铜丝上可观察到的现象是______________,解释该现象的化学反应方程式为____________;
实验二 乙醛的提纯
上述实验获得的乙醛含有较多乙醇,可以通过以下操作提纯。

已知:CH3CHO+NaHSO3![]()
![]() (a-羟基乙磺酸钠)
(a-羟基乙磺酸钠)
(2)写出Na2CO3溶液参与反应的化学方程式:________________;
(3)某同学设计操作B的装置(夹持和加热装置已略去)如图所示。
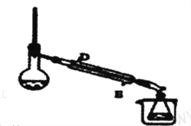
①冷凝管中的液体应从_____口进。(填“D”或“E”)
②下列有关操作与装置的分析,正确的是_____。(填字母)
a.烧杯中应装冰水 b.冷凝管应通温水 c.图示装置可用于除去乙酸乙酯中混有的乙醇
实验三 乙醛溶液浓度的测定
室温下利用反应Na2SO3+CH3CHO+H2O→CH3CH(OH)SO3Na↓+NaOH可以测定“实验一”中试管a内乙醛溶液浓度,操作如下:
取试管a中溶液4mL,加入1mL饱和Na2SO3溶液(过量),再加入5mL水,充分振荡后用pH计测定溶液pH;另取试管b,加入4mL乙醇做空白试验,实验结果如右表:
实验试管 | pH | ||
第一次 | 第二次 | 第三次 | |
A | 12.42 | 12.40 | 12.38 |
b | 10.43 | 10.43 | 10.40 |
(4)试管a中乙醛溶液的物质的量浓度为___mol/L。(列出计算式即可)