题目内容
【题目】早在西汉时期就有记载“曾青得铁则化为铜”,成为现代湿法冶金的先驱,要加快该化学反应的速率,所采取的下列措施无效的是( )
A.增大硫酸铜的浓度B.提高反应的温度
C.增大压强D.用铁粉代替铁片
【答案】C
【解析】
影响反应速率的因素很多,有温度、浓度、接触面积等。
A.增大反应物浓度会加快反应速率,增大硫酸铜的浓度是有效的, A项错误;
B.升高温度,加快反应速率,B项错误;
C.该反应无气体参加,增大压强对反应速率没有影响,C项正确;
D.铁粉代替铁片,增大了反应物的接触面积,加快了反应速率, D项错误;
答案选C。

【题目】过渡金属催化的反应已成为重要的合成工具,贵金属成本高,会对环境造成的不利影响。因此研究成本低廉的含锰、铁、钴、镍、铜等催化剂应用成为热点。以下是以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程:
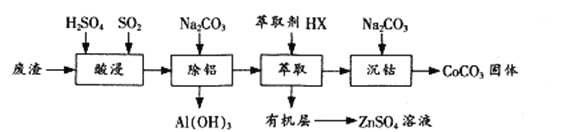
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
回答下列问题:
(1)“酸浸”时通入SO2的目的是 ____________,反应的离子方程式为______________。
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________。
(3)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 ____________。
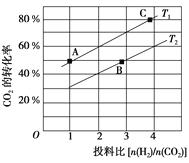
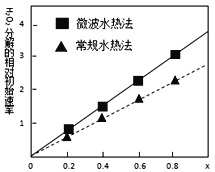
(4)用得到的CoCO3等为原料采用微波水热法和常规水热法可以制得两种CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。如图是两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:____________法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是____________ 。
(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中![]() =___________。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3)=1.4×10- 13]
=___________。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3)=1.4×10- 13]
【题目】四氯化钛(TiCl4)是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体。某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如图所示。
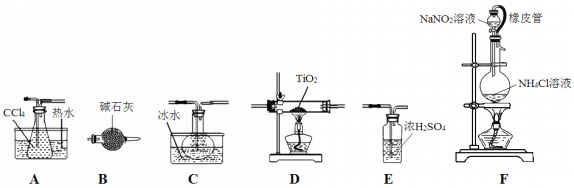
有关信息如下:
①反应原理:TiO2(s)+CCl4(g) △ T iCl4(g)+CO2(g)。
②反应条件:无水无氧且加热。
③有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它 |
CCl4 | 23 | 76 | 与TiCl4互溶 |
TiCl4 | 25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)装置F橡皮管的作用是_________________________________________,装置F中有氮气生成,该反应的化学方程式为__________________________________________。
(2)实验装置依次连接的顺序为F→B→_____→_____→_____→_____。________________
(3)欲分离C中的液态混合物,所采用操作的名称是_____________。
(4)实验开始前首先点燃____处酒精灯(填“D或F”),目的是___________________。
(5)E装置______(填“能或不能”)换成B装置,理由是________________________。