题目内容
18.下列物质属于强电解质的是( )| A. | 盐酸 | B. | HF | C. | BaSO4 | D. | Cu |
分析 电解质是化合物,电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子.电解质包括离子型或强极性共价型化合物.强电解质一般是强酸、强碱和活泼金属氧化物以及大部分盐,它们溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物,抓住这些特点即可解题.
解答 解:A、盐酸是HCl的水溶液,是混合物,不是电解质,更不是强电解质,故A错误;
B、HF是弱酸,是弱电解质,故B错误;
C、BaSO4是盐,是强电解质,故C正确;
D、Cu是单质,不是化合物,故不是电解质,更不是强电解质,故D错误.
故选C.
点评 本题是对基本概念强电解质的考查,题目难度不大,平时学习注意概念的辨析、基础知识的积累.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 用乙醇萃取碘水中的碘 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 用食醋可除去热水壶内壁的水垢 | |
| D. | 光导纤维是将太阳能转化为电能的常用材料 |
6.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 2molNa被完全氧化生成Na2O2,失去个2nA电子 | |
| B. | 1 mol•L-1 的K2SO4溶液中有2nA个K+ | |
| C. | 常温常压下,22.4 L乙烯中C-H键的数目为4nA | |
| D. | 常温常压下,16gCH4中含有的电子数为10nA |
13.下列式子书写正确的是( )
| A. | 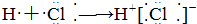 | B. | 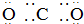 | ||
| C. | 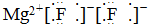 | D. |  |
3.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 | |
| B. | 0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 100mL0.1mol/L Na2SO4溶液中,粒子总数是0.03NA | |
| D. | 常温常压下,14g N2含有分子数为0.5NA |
10.在一定条件下,使CO和O2的混合气体30g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,下列关于混合气体的描述不正确的是( )
| A. | 原混合气体的平均摩尔质量为30g/mol | |
| B. | 原混合气体中CO和O2的物质的量之比为1:1 | |
| C. | 反应后的混合气体含有O2和CO2 | |
| D. | 反应后O2的物质的量比反应前的多 |
6.取3mL 5mol.L-1H2 O2溶液,加入少量MnO2粉末,2min时c(H2O2)降为1mol/L.下列说法不正确的是( )
| A. | 2 min内,v(H2O2)=2 mol.L-1•min-l | |
| B. | MnOp是催化剂,能加快H2 O2的分解速率 | |
| C. | 升高温度或增大H2 O2的浓度,均能加快H2O2的分解速率 | |
| D. | 若将5 mol•L-1 H2O2溶液的体积增至6 mL,则H2O2的分解速率增至原来的2倍 |