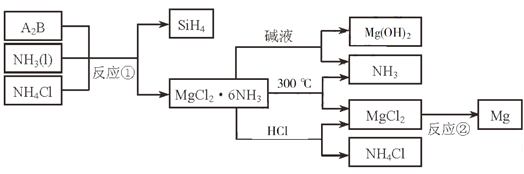
题目内容
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式:____________。
(2)实验装置(如图所示,量气管为碱式滴定管改装)
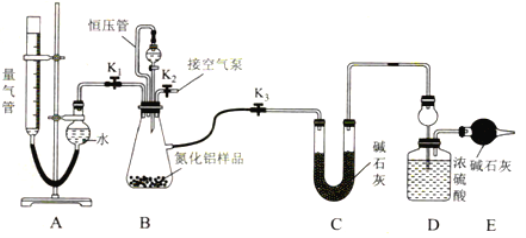
连好装置后,首先应进行的操作是________。
(3)实验过程:称得装置D的初始质量为y g;称取x g AlN样品置于装置B锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管的初始读数为a mL(量气装置左右液面相平)。
①欲首先测量Al4C3质量分数的有关数据,对三个活塞的操作是________。
②若无恒压管,对所测气体体积的影响是________(填“偏大”“偏小”或“无影响”)
③量气管中液面不再发生变化,说明反应已经结束。读取读数之前,应对量气管进行调整量气管高度,使左右两边液面相平 ,若量气管中的液面高于右侧球形容器中的液面,所测气体的体积______(填“偏大”“偏小”或“无影响”)。
④记录滴定管的读数为b mL(已知:该实验条件下的气体摩尔体积为Vm L·mol-1),则Al4C3的质量分数为______(用含a、b、x、y、Vm的代数式表示)。
⑤测量AlN质量分数的数据:首先关闭活塞 K1 ,打开活塞K3,通过分液漏斗加入过量___,与装置B瓶内物质充分反应;反应完成后,____(填入该步应进行的操作),最后称得装置D的质量为z g。
【答案】AlN+NaOH+H2O=NaAlO2+NH3↑ 检查装置的气密性 关闭活塞K2、K3,打开活塞K1 偏大 偏小 ![]() ×100% NaOH溶液 打开K2,通入一段时间空气
×100% NaOH溶液 打开K2,通入一段时间空气
【解析】
(1)AlN与NaOH溶液反应生成偏铝酸钠和氨气;
(2)涉及气体的实验要检验装置气密性;
(3)①欲首先测量Al4C3质量分数,需测量Al4C3与硫酸反应生成甲烷的体积;
②若无恒压管,分液漏斗中的液体排出部分B中的空气;
③若量气管中的液面高于右侧球形容器中的液面,则球形容器中压强偏大;
④记录滴定管的读数为bm L(已知:该实验条件下的气体摩尔体积为Vm L·mol-1),生成甲烷的物质的量是![]() ;
;
⑤AlN与强碱生成氨气,氨气被D吸收,根据D的质量变化计算AlN的质量;
(1)AlN与NaOH溶液反应生成偏铝酸钠和氨气,反应方程式是AlN+NaOH+H2O=NaAlO2+NH3↑;
(2)连好装置后,首先应进行的操作检查装置的气密性;
(3)①欲首先测量Al4C3质量分数,测量Al4C3与硫酸反应生成甲烷的体积,应关闭活塞K2、K3,打开活塞K1,用排水量气法测量生成甲烷的体积;
②若无恒压管,分液漏斗中的液体排出部分B中的空气,测量甲烷的体积偏大;
③若量气管中的液面高于右侧球形容器中的液面,则球形容器中压强偏大,所测气体的体积偏小;
④记录滴定管的读数为b mL(已知:该实验条件下的气体摩尔体积为Vm L·mol-1),生成甲烷的物质的量是![]() ,根据碳元素守恒,Al4C3的物质的量是
,根据碳元素守恒,Al4C3的物质的量是![]() ,Al4C3的质量分数为
,Al4C3的质量分数为![]()
![]() 100% ;
100% ;
⑤AlN与强碱生成氨气,所以分液漏斗加入过量NaOH溶液,与装置B瓶内物质充分反应;反应完成后,打开K2,通一段时间空气,将B中氨气完全赶进D中吸收。

【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D