题目内容
【题目】甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________,该反应的平衡常数表达式K=___________
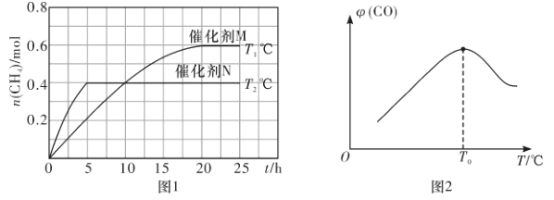
③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(![]() )与温度(T)的关系如图2所示。T0℃时,CO的体积分数最大的原因为_________________________________。该反应的△H_______0(填“>”“<”)
)与温度(T)的关系如图2所示。T0℃时,CO的体积分数最大的原因为_________________________________。该反应的△H_______0(填“>”“<”)
【答案】+44 kJmol﹣1 0.006 molL﹣1h﹣1 K=![]() > 该反应为吸热反应,温度升高,CH4的产量增大 弱于 低于T0 ℃时,相同时间段内温度越高反应速率越快,CO的体积分数越大;高于T0 ℃时,反应达到平衡,该反应为放热反应,温度越高CO的体积分数越小 (答案合理给分) <
> 该反应为吸热反应,温度升高,CH4的产量增大 弱于 低于T0 ℃时,相同时间段内温度越高反应速率越快,CO的体积分数越大;高于T0 ℃时,反应达到平衡,该反应为放热反应,温度越高CO的体积分数越小 (答案合理给分) <
【解析】
(1)①若甲烷的燃烧热(△H)为-890kJ·mol-1,则CH4(g)+O2(g)===CO2(g)+2H2O(l) ΔH= - 890kJ/mol;
②v(H2O)=![]() ;平衡常数是生成物浓度系数次方的乘积与反应物浓度系数次方乘积的比;
;平衡常数是生成物浓度系数次方的乘积与反应物浓度系数次方乘积的比;
③催化剂对平衡移动无影响,正反应吸热,升高温度平衡正向移动,甲烷的物质的量增大;
催化剂影响反应速率;
(2)温度越高,反应速率越快,CO的体积分数增大;T0℃后,温度升高CO的体积分数减小,说明平衡逆向移动。
(1)①若甲烷的燃烧热(△H)为-890kJ·mol-1,则CH4(g)+O2(g)===CO2(g)+2H2O(l) ΔH= -890kJ/mol;②CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H= +802kJ·mol-1。根据盖斯定律 ①+②得2H2O(g)=2H2O(l) ΔH= -88kJ/mol,水的汽化热△H= +44 kJmol-1;
CH4(g)+2O2(g) △H= +802kJ·mol-1。根据盖斯定律 ①+②得2H2O(g)=2H2O(l) ΔH= -88kJ/mol,水的汽化热△H= +44 kJmol-1;
②T1℃、催化剂M作用下,0~20h内生成甲烷0.6mol,则消耗水1.2mol,该反应速率v(H2O)= ![]() =
=![]() =0.006 molL-1h-1,该反应的平衡常数表达式K=
=0.006 molL-1h-1,该反应的平衡常数表达式K=![]() ;
;
③催化剂对平衡移动无影响,正反应吸热,升高温度平衡正向移动,甲烷的物质的量增大,平衡时甲烷的物质的量M大于N,所以T1>T2;T1>T2,但M的速率小于N,所以催化剂的催化效果:M弱于N;
(2). 低于T0 ℃时,相同时间段内温度越高反应速率越快,CO的体积分数越大;高于T0 ℃时,反应达到平衡,温度越高CO的体积分数越小,所以T0℃时,CO的体积分数最大;温度越高CO的体积分数越小,说明正反应放热,△H<0。