题目内容
【题目】利用“化学计量在实验中的应用”的相关知识进行填空(设NA表示阿伏加德罗常数的值)。
(1)标准状况下,0.2 mol氨气的体积是__________, 其中含有的NH3分子数是__________,
(2) 20℃时,饱和KCl溶液的密度为0.745g·cm﹣3,物质的量浓度为4.0 mol·L﹣1,则此溶液中KCl 的质量分数为______
(3)从500 mL 0.2 mol/L Na2SO4 溶液中取出10 mL,取出的Na2SO4溶液物质的量浓度为___mol/L;若将这10 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为______mol/L。
(4)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是______;ACl2的化学式是_________。
(5)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl-的物质的量之比为________
(6)300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶300mL,反应后溶液中SO42﹣的物质的量的浓度为__________(混合体积看成两液体体积之和)
【答案】4.48L 1.204×1023 40% 0.2 mol/L 0.04mol/L 95g/mol MgCl2 3:4:3 0.1mol/L
【解析】
根据物质的量与气体体积、物质的量的浓度等物理量之间的关系计算解答。
(1)![]() ;
;![]() ,故答案为:4.48L;1.204×1023;
,故答案为:4.48L;1.204×1023;
(2) ![]() ,故答案为:40%;
,故答案为:40%;
(3)溶液是均匀的,所以取出的Na2SO4溶液物质的量浓度为0.2 mol/L ;c(Na+)=0.2 mol/L×2=0.4 mol/L,稀释后的浓度为0.4 mol/L×1/10=0.04mol/L,故答案为:0.2 mol/L;0.04mol/L;
(4)n(ACl2)=![]() ,M(ACl2)=
,M(ACl2)=![]() ,则ACl2的摩尔质量是95g/mol;Cl的相对原子质量为35.5,则A的相对原子质量为24,则A为Mg,ACl2的化学式是MgCl2,故答案为:95g/mol;MgCl2;
,则ACl2的摩尔质量是95g/mol;Cl的相对原子质量为35.5,则A的相对原子质量为24,则A为Mg,ACl2的化学式是MgCl2,故答案为:95g/mol;MgCl2;
(5)n=cV,则三种溶液中Cl-的物质的量之比为(1×1×3):(1×2×2):(1×3×1)=3:4:3,故答案为:3:4:3;
(6)硫酸铝溶液中,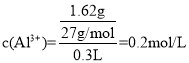 ,根据化学式知c(SO42-)=3/2c(Al3+)=
,根据化学式知c(SO42-)=3/2c(Al3+)=![]() ×0.2mol/L=0.3mol/L,n(SO42-)=0.3mol/L×0.3L=0.09mol;向该溶液中加入氢氧化钡,二者反应生成硫酸钡和水;n[Ba(OH)2]=0.1mol/L×0.3L=0.03mol,0.03mol钡离子完全反应需要0.03mol硫酸根离子,则混合溶液中剩余n(SO42-)=0.09mol-0.03mol=0.06mol,混合溶液中硫酸根离子物质的量浓度
×0.2mol/L=0.3mol/L,n(SO42-)=0.3mol/L×0.3L=0.09mol;向该溶液中加入氢氧化钡,二者反应生成硫酸钡和水;n[Ba(OH)2]=0.1mol/L×0.3L=0.03mol,0.03mol钡离子完全反应需要0.03mol硫酸根离子,则混合溶液中剩余n(SO42-)=0.09mol-0.03mol=0.06mol,混合溶液中硫酸根离子物质的量浓度![]() ,故答案为:0.1mol/L。
,故答案为:0.1mol/L。

 科学实验活动册系列答案
科学实验活动册系列答案