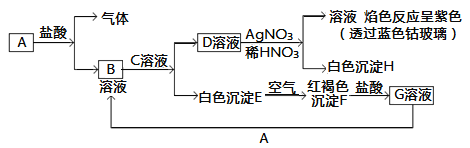
��Ŀ����
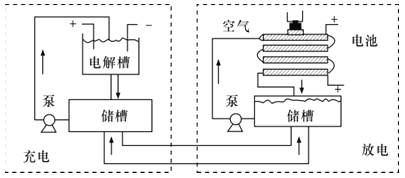
����Ŀ���о����֣�������ʯī�����������������������ڵ�CaF2��CaO������ʣ�����ͼʾװ�û�ý����ƣ����Ը�Ϊ��ԭ����ԭ���������Ʊ������ѡ�����˵���д������

A. ���Ʊ�������ǰ������װ����CaO���������ֲ���
B. �����ĵ缫��ӦʽΪC��2O2����4e��===CO2��
C. ��TiO2�Ƶ�1 mol����Ti�����������·ͨ��2 mol ����
D. ����Ǧ�����������Դ��������������Ӧ����Pb�缫
���𰸡�C
��������
��ͼ��֪�����Դ����������ʯī�缫Ϊ������������Cʧȥ���ӷ���������Ӧ���ɶ�����̼���缫��ӦʽΪC+2O2--4e-�TCO2�������Դ��������������Ϊ������������Ca2+�õ��ӷ�����ԭ��Ӧ����Ca���缫��ӦʽΪ��Ca2++2e-�TCa����Ӧ���ɵĸƻ�ԭ���������Ƶ�Ti����Ӧ�Ļ�ѧ����ʽΪ��2Ca+TiO2=Ti+2CaO��
A�������Ca2+�õ��ӷ�����ԭ��Ӧ����Ca���缫��ӦʽΪ��Ca2++2e-�TCa����Ӧ���ɵĸƻ�ԭ���������Ƶ�Ti����Ӧ�Ļ�ѧ����ʽΪ��2Ca+TiO2=Ti+2CaO�����Ʊ�������ǰ������װ����CaO���������ֲ��䣬��A��ȷ��
B�������Cʧȥ���ӷ���������Ӧ���ɶ�����̼���缫��ӦʽΪC+2O2--4e-�TCO2������B��ȷ��
C�TiO2��TiԪ�صĻ��ϼ�Ϊ+4����TiO2�Ƶ�1 mol����Ti����Ӧת��4 mol ���ӣ������������·ͨ��4 mol ���ӣ���C����
D�PbΪǦ���صĸ�������������������Ӧ����Pb�缫����D��ȷ��
��ѡC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�