题目内容
【题目】40℃时,在氨—水体系中不断通入CO2,各种粒子的浓度变化趋势如图所示。下列说法不正确的是
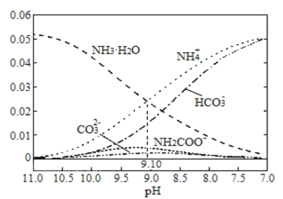
A.40℃时,K(NH3·H2O)=10-9.10
B.不同pH的溶液中均存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C.随着CO2的通入,![]() 不断减小
不断减小
D.随溶液pH不断降低,生成的中间产物NH2COONH4又不断转化为NH4HCO3
【答案】A
【解析】
A. 在溶液pH=9.10时c(NH4+)=c(NH3·H2O),Kb(NH3·H2O)= =c(OH-),由于Kw=c(H+)·c(OH-)是常数,只与温度有关,若温度为室温,则Kw=10-14,pH=9.10时,c(H+)=10-9.10,c(OH-)=
=c(OH-),由于Kw=c(H+)·c(OH-)是常数,只与温度有关,若温度为室温,则Kw=10-14,pH=9.10时,c(H+)=10-9.10,c(OH-)=![]() =10-4.9,Kb(NH3·H2O)= c(OH-)=10-4.9,升高温度,促进电解质的电离,所以温度为40℃时,K(NH3·H2O)>10-4.9,A错误;
=10-4.9,Kb(NH3·H2O)= c(OH-)=10-4.9,升高温度,促进电解质的电离,所以温度为40℃时,K(NH3·H2O)>10-4.9,A错误;
B. 溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则不同pH的溶液中存在电荷守恒关系为:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-),B正确;
C. 已知Kb= ,温度一定时,Kb为常数,随着CO2的通入,c(NH4+)逐渐增大,则
,温度一定时,Kb为常数,随着CO2的通入,c(NH4+)逐渐增大,则 不断减小,C正确;
不断减小,C正确;
D. 由图象可知:开始溶液pH较大时没有NH2COO-,后来随着溶液pH的降低,反应产生NH2COO-,并且逐渐增多,当pH减小到一定程度NH2COO-逐渐减小直至消失,同时NH4HCO3又逐渐增多,即在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成,后NH2COO-转化为NH4HCO3,D正确;
故合理选项是A。

练习册系列答案
相关题目