题目内容
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 ①
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 ②
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 下列说法正确的是( )
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.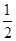 H2SO4(aq)+ H2SO4(aq)+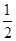 Ba(OH)2(aq)= Ba(OH)2(aq)= 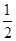 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
B
解析考点分析:由题意可知H2(g)的燃烧热为285.8kJ·mol-1,C项有沉淀生成,△H不等于-57.3 kJ·mol-1,由盖斯定律得D项方程式可由(①×3-②)/2, △H为-131.4 kJ·mol-1.
考点:热化学方程式的书写。

练习册系列答案
相关题目
下列说法中,正确的是
| A.放热反应不需要加热就可以发生 |
| B.化学反应除了生成新物质外,还伴随着能量的变化 |
| C.反应条件为加热的反应都是吸热反应 |
| D.化学反应放热还是吸热,取决于反应条件 |
下列说法不正确的是( )
| A.煤转化为煤气后燃烧,可以提高燃烧效率 |
| B.在生产、流通和消费等过程中实行“减量化、再利用、资源化” |
| C.化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体 |
| D.天然气是气体,它不属于化石燃料 |
下列说法或表示方法正确的是( )
| A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度 |
| B.31g红磷变成31g白磷要吸收能量,说明白磷比红磷更稳定 |
| C.在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(g) ΔH=-571.6 kJ/mol |
| D.2A (l) + B (l) =" 2C" (l) △H1 2A (g) + B (g) =" 2C" (l)△H2 则ΔH1>ΔH2 |
下列说法正确的是
| A.在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol |
| B.在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为 —285.8kJ/mol |
| C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D.在稀溶液中:H+(aq) + OH--(aq) ="==" H2O(l);△H= —57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
下列关于热化学反应的描述中正确的是( )
| A.已知H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热 ΔH=2×(-57.3) kJ·mol-1 |
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+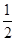 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1;则CH3OH(g)的燃烧热为192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1;则CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
| C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)ΔH=+571.6 kJ·mol-1 |
D.葡萄糖的燃烧热是2800 kJ·mol-1,则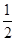 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1 |
下列有关中和热的说法正确的是( )
| A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH=-57.3 kJ/mol |
| B.准确测量中和热的实验过程中,至少需测定温度4次 |
| C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 |
| D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol |
