题目内容
已知:P4 (s、白磷) + 5O2 (g) = P4O10 (s) ΔH =" a" kJ/mol
P (s、红磷) + 5/4 O2(g) = 1/4P4O10(s) ΔH =" b" kJ/mol
试写出白磷转化为红磷的热化学方程式 。
P4 (s、白磷) + 5O2 (g) =" 4" P (s、红磷) ΔH ="(" a –4b) kJ/mol
解析试题分析:将第二个方程式左右同乘4然后用第一个方程减去第二个方程得出。
考点:考查白磷转红磷

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 ①
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 ②
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 下列说法正确的是( )
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.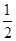 H2SO4(aq)+ H2SO4(aq)+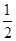 Ba(OH)2(aq)= Ba(OH)2(aq)= 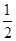 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
下列有关热化学方程式的叙述正确的是( )
| A.已知2H2(g)+O2(g)= 2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B.已知C(石墨,s)= C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g) ;△H2。则△H1<△H2 |
火箭推进器中盛有液态肼(N2H4)和液态双氧水,当它们混合时,立即产生氮气和水蒸气,并放出大量的热。已知6.4 g液态肼与足量的液态双氧水反应生成氮气和水蒸气时,放出128.326 kJ的热量。下列热化学方程式正确的是( )
| A.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=128.326 kJ·mol-1 |
| B.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-128.326 kJ·mol-1 |
| C.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1 |
| D.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-256.625 kJ·mol-1 |
下列说法正确的是( )
| A.反应热就是反应中放出的热量 |
| B.放热反应的△H>0,吸热反应的△H<0 |
| C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,△H为“—” |
| D.一个化学反应中,生成物的总键能大于反应物的总键能时,反应吸热,△H为“+” |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
下列说法正确的是
| A.吸热反应在常温下一定不能发生 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.已知C(石墨,s)=C(金刚石,s),△H1>0,说明石墨比金刚石稳定 |
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的 不同 不同 |
人类将在几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是
| A.煤、石油和天然气都属于碳素燃料 |
| B.发展太阳能经济有助于减缓温室效应 |
| C.太阳能电池可将太阳能直接转化为电能 |
| D.目前研究菠菜蛋白质“发电”不属于太阳能文明 |
下列关于热化学反应的描述中正确的是( )
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |
| B.吸热反应一定需要加热才能发生 |
| C.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| D.CO燃烧热为283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)的ΔH=+566.0 kJ·mol-1 |