题目内容
下列关于热化学反应的描述中正确的是( )
| A.已知H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热 ΔH=2×(-57.3) kJ·mol-1 |
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+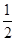 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1;则CH3OH(g)的燃烧热为192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1;则CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
| C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)ΔH=+571.6 kJ·mol-1 |
D.葡萄糖的燃烧热是2800 kJ·mol-1,则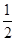 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1 |
D
解析试题分析:H2SO4和Ba(OH)2反应除了生成水以外,还有难溶的沉淀生成,所以该反应生成1mol水时的热效应不是中和热,A错误;燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时的热效应,但是该反应生成的氢气不是稳定产物,所以该热效应不是燃烧热,B错误;表示H2(g)的燃烧热时生成的是液态水,所以C错误;葡萄糖1mol燃烧的热效应为2800 kJ·mol-1 ,所以当系数为1/2时,热效应为其一半-1400 kJ·mol-1 ,所以D正确,选D。
考点:本题考查的是热化学方程式的正误判断以及中和热、燃烧热的定义。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案下列有关热化学方程式的叙述正确的是
| A.已知2H2O(g) =2H2(g)+O2(g) △H=+483.6 kJ/mol,则氢气的燃烧热为△H=-241.8kJ/mol |
| B.已知C(石墨,s)= C(金刚石,s)△H>0,则金刚石不如石墨稳定 |
| C.已知中和热为△H=-57.4kJ/mol,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) △H=-57.4kJ/mol |
| D.已知2C(s)+2O2(g)=2CO2 (g) △H1;2C(s)+O2 (g)=2CO(g) △H2,则△H1>△H2 |
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 ①
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 ②
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 下列说法正确的是( )
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.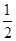 H2SO4(aq)+ H2SO4(aq)+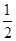 Ba(OH)2(aq)= Ba(OH)2(aq)= 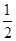 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
下列依据热化学方程式得出的结论正确的是
| A.已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法错误的是( )
| A.改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 |
| B.用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用50mL0.50mol/L盐酸50mL0.50mol/LNaOH测得的数值准确 |
| C.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 |
| D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
某反应的反应过程中能量变化如图所示(图中E表示活化能)。下列叙述正确的是( )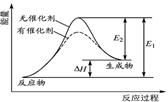
| A.逆反应的活化能大于正反应的活化能 |
| B.该反应为放热反应 |
| C.催化剂能改变反应的焓变 |
| D.催化剂能降低反应的活化能 |
下列有关热化学方程式的叙述正确的是( )
| A.已知2H2(g)+O2(g)= 2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B.已知C(石墨,s)= C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g) ;△H2。则△H1<△H2 |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
