题目内容
【题目】钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题.
在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如下: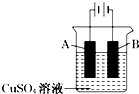
①A电极对应的金属是(写元素名称),B电极的电极反应式是;
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为;
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 .
【答案】铜;Cu2++2e﹣═Cu;0.08;铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀
【解析】解:①电镀时,镀层铜作阳极,镀件铁作阴极,所以A是铜,B是铁,阴极上铜离子得电子生成铜,电极反应式为Cu2++2e﹣═Cu,
所以答案是:铜;Cu2++2e﹣═Cu;
②阳极上铜失电子发生氧化反应,阴极上铜离子得电子发生还原反应,若电镀前铁、铜两片金属质量相同,电镀完成后二者质量差为5.12g,二者质量差的一半为阴极析出的铜,则转移电子的物质的量= ![]() =0.08mol,
=0.08mol,
所以答案是:0.08;
③锌、铁和电解质溶液构成原电池时,锌易失电子作负极,铁作正极被保护,铜、铁和电解质溶液构成原电池时,铁易失电子作负极被腐蚀,所以镀铜铁比镀锌铁更容易被腐蚀,
所以答案是:铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.
【考点精析】掌握金属的电化学腐蚀与防护是解答本题的根本,需要知道金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法.

 阅读快车系列答案
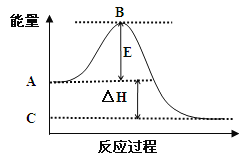
阅读快车系列答案【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=a kJ mol﹣1
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ mol﹣1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ mol﹣1
则a=kJ mol﹣1 .
(2)冶炼铁反应的平衡常数表达式K= , 温度升高后,K值(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
Fe2O3 | CO | Fe | CO21 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为 .
②下列说法正确的是(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态 b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2:3 d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.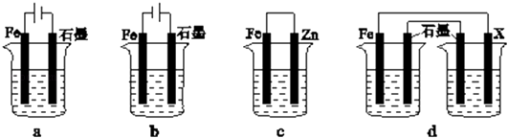
①在a~c装置中,能保护铁的是(填字母).
②若用d装置保护铁,X极的电极材料应是(填名称).