题目内容
12.化合物丙由如下反应得到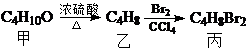 ;丙不可能是( )
;丙不可能是( )| A. | CH3CH2CHBrCH2Br | B. | (CH3)2CBrCH2Br | C. | CH3CHBrCHBrCH3 | D. | CH3CH (CH2Br)2 |
分析 由甲与乙的分子式可知,丁醇发生消去反应生成丁烯,丁烯与溴发生加成反应,两个溴原子应分别连接在相邻的碳原子上,得到二溴丁烷,判断出C4H8的烯烃的同分异构体来解答.
解答 解:C4H8属于烯烃的可能的同分异构体,有CH2═CH2CH2CH3、CH3CH═CHCH3、CH2═C(CH3)2.
A.若乙为CH2═CH2CH2CH3,与溴发生加成反应生成CH3CH2CHBrCH2Br,故A正确;
B.若乙为CH2═C(CH3)2,与溴发生加成反应生成(CH3)2CBrCH2Br,故B正确;
C.若乙为CH3CH═CHCH3,与溴发生加成反应生成CH3CHBrCHBrCH3,故C正确;
D.C4H8为烯烃,与溴发生加成反应后溴原子处于相邻的2个碳原子上,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇、烯烃的性质及分析与应用能力的考查,题目难度不大.

练习册系列答案
 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
3.下列说法正确的是( )
| A. | 非金属元素构成的单质中一定存在共价键 | |
| B. | 非金属元素构成的化合物一定是共价化合物 | |
| C. | 离子化合物中一定含有离子键 | |
| D. | 一种化合物中只能存在一种类型的化学键 |
7.下列各组物质,不能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水 | B. | 溴苯和水 | C. | 苯和甲苯 | D. | 硝基苯和水 |
17.通常是用加热分解的方法冶炼的金属是( )
| A. | Na | B. | Mg | C. | Ag | D. | Fe |
2.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳,2CH3OH(g)+3O2(g)=4H2O(1)+2CO2(g)( )
| A. | 该电池中通入甲醇的电极为电源的正极 | |
| B. | 氧气被还原 | |
| C. | 当导线中通过4mol电子时,消耗甲醇的物质的量为1mol | |
| D. | 溶液中的H+向通甲醇的电极运动 |
 ;
;

