题目内容
5.根据元素性质周期表递变规律,下列判断均正确的是( )| A. | 酸性:HClO4>HBrO4>HIO4 碱性:NaOH>KOH>RbOH | |
| B. | 原子半径:Na>O>F 离子半径::Na+>O2->F- | |
| C. | 稳定性::HF>H2O>H2S 还原性:HCl<H2S<PH3 | |
| D. | 还原性:Na>Mg>Al 氧化性:P>S>Cl2 |
分析 A、非金属性越强最高价氧化物对应水化物的酸性越强;金属性越强最高价氧化物对应水化物的碱性越强;
B、电子层数越多半径越大,电子层相同时核电荷数越多半径越小;
C、非金属性越强,气态氢化物越稳定;非金属性越强,对应氢化物的还原性越弱;
D、金属性越强对应单质的还原性越强;非金属性越强对应单质的氧化性越强.
解答 解:A、非金属性Cl>Br>I,所以酸性:HClO4>HBrO4>HIO4,金属性Rb>K>Na,所以碱性:NaOH<KOH<RbOH,故A错误;
B、电子层数越多半径越大,电子层相同时核电荷数越多半径越小,所以半径Na>O>F,O2->F->Na+,故B错误;
C、非金属性F>O>S,所以气态氢化物越稳定:HF>H2O>H2S;非金属性Cl>S>P,所以对应氢化物的还原性:HCl<H2S<PH3,故C正确;
D、金属性:Na>Mg>Al,所以还原性:Na>Mg>Al;非金属性Cl>S>P,所以氧化性:P<S<Cl2,故D错误;
故选C.
点评 本题考查元素的性质,为高频考点,把握同主族、同周期元素的性质比较规律为解答的关键,注意元素周期律的应用和规律性知识的归纳,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.铀的一种核素${\;}_{92}^{235}$U,这里的“235”表示的是( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 质量数 |
10.根据下列操作及现象,所得结论正确的是( )
| 序号 | 操作及现象 | 结论 |
| A | 向2mL1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3 | Mg(OH)2转化为Fe(OH)3 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度:CO32->HCO3- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
17.设NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 7.8gNa2O2和 Na2S混合物中所含阴离子的数目为0.1NA | |
| B. | 0.1mol丙烷中含有的共价键数目为0.8NA | |
| C. | 标准状况下,11.2LSO2中含有分子的数目为0.5NA | |
| D. | t℃,MgCO3的Kap=4×14-4,则饱和饱和溶液中含Mg2+数目为2×10-3NA |
14.下列做法不利于环境保护的是( )
| A. | 使用可降解塑料制品 | |
| B. | 工业废气排入大气 | |
| C. | 对化石燃料进行综合利用 | |
| D. | 尽量采取步行、骑自行车或乘坐公共交通工具等方式出行 |
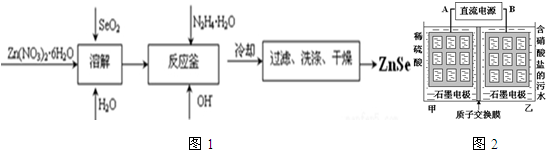
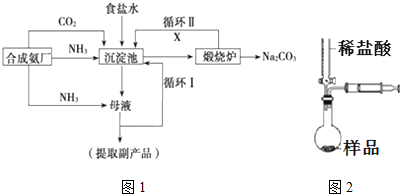
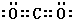 ,沉淀池中发生的化学反应方程式为:CO2+NH3+NaCl+H2O═NaHCO3↓+NH4Cl.
,沉淀池中发生的化学反应方程式为:CO2+NH3+NaCl+H2O═NaHCO3↓+NH4Cl.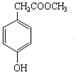 的分子式是C9H10O3,1mol化合物I完全燃烧,消耗10mol氧气.
的分子式是C9H10O3,1mol化合物I完全燃烧,消耗10mol氧气. .
.