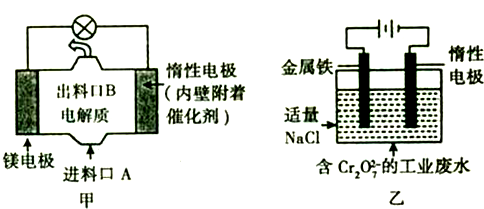
题目内容
7.下列离子方程式书写正确的是( )| A. | 盐酸和氨水反应 H++OH-=H2O | |
| B. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气和氢氧化钠溶液反应 Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 铜和稀硝酸反应 Cu+2NO3-+4H+=2Cu2++2NO2↑+2H2O |
分析 A.一水合氨为弱电解质,应保留化学式;
B.电荷不守恒;
C.氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
D.不符合反应客观事实,铜与稀硝酸反应生成一氧化氮.
解答 解:A.盐酸和氨水反应,离子方程式:NH3•H2O+H+═NH4++H2O,故A错误;
B.钠和冷水反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,故C正确;
D.铜和稀硝酸反应,离子方程式:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子方程式书写应遵循反应客观事实、电荷守恒、原子个数守恒规律,注意化学式的拆分.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
12.下列除杂的有关操作和试剂均正确的是( )
| 组别 | 被提纯物质 | 杂质 | 除杂试剂 | 除杂操作 |
| A | CO2 | SO2 | Na2CO3溶液 | 洗气 |
| B | 乙酸乙酯 | 乙酸 | 乙醇和浓H2SO4 | 加热 |
| C | 乙烷 | 乙烯 | 溴水、碱石灰 | 洗气 |
| D |  | CH3CH2OH | H2O | 分液 |
| A. | A | B. | B | C. | C | D. | D |
15.铀的一种核素${\;}_{92}^{235}$U,这里的“235”表示的是( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 质量数 |
2.下列气体中,不能用排空气法收集的是( )
| A. | NO | B. | SO2 | C. | CO2 | D. | NO2 |
12.下列物质可用于干燥氨气的是( )
| A. | 浓硫酸 | B. | 碱石灰 | C. | 过氧化钠 | D. | 活性炭 |
19.对下列事故预防或处理方法正确的是( )
| A. | 钠、钾着火时用水灭火 | |
| B. | 点燃氢气前要验纯,点燃甲烷前不必验纯 | |
| C. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上浓硫酸 | |
| D. | 稀释浓硫酸时,为防止液体飞溅,将浓硫酸沿烧杯壁缓缓加入水中,并不断搅拌 |
17.设NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 7.8gNa2O2和 Na2S混合物中所含阴离子的数目为0.1NA | |
| B. | 0.1mol丙烷中含有的共价键数目为0.8NA | |
| C. | 标准状况下,11.2LSO2中含有分子的数目为0.5NA | |
| D. | t℃,MgCO3的Kap=4×14-4,则饱和饱和溶液中含Mg2+数目为2×10-3NA |
 .
.