题目内容
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充人1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )
 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当符合:3u正(N2)=u正(H2)时,反应达到平衡状态 |
| C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2 |
| D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态 |
C
(中难)考查化学平衡的涵义及其与反应速率之间的内在联系,本题与前些年高考中所考的“达到平衡状态的标志”属于同一题型。达到化学平衡时,正反应和逆反应的速率相等,但不为零,化学平衡是动态平衡,反应并没有停止,A错。B中只有正反应速率,无法判断是否平衡,要有正逆反应速率,且速率比符合化学计量数之比,才能说明反应已达到平衡状态,C符合要求。
错点警示:从化学平衡的定义出发来判断是否达到化学平衡的两个要点是:①v正 = v逆 ②能变的量保持不变。达到化学平衡时,反应混合物中各组成成分的百分含量、物质的量浓度等保持不变,并不是指各组成成分的百分含量、物质的量浓度等一定相等或符合某一比例。
错点警示:从化学平衡的定义出发来判断是否达到化学平衡的两个要点是:①v正 = v逆 ②能变的量保持不变。达到化学平衡时,反应混合物中各组成成分的百分含量、物质的量浓度等保持不变,并不是指各组成成分的百分含量、物质的量浓度等一定相等或符合某一比例。

练习册系列答案
相关题目
 Fe(s)+CO2(g)(正反应为吸热反应),其平衡常数可表达为K=[CO2]/[CO],已知,1 100 ℃时,K=0.263。
Fe(s)+CO2(g)(正反应为吸热反应),其平衡常数可表达为K=[CO2]/[CO],已知,1 100 ℃时,K=0.263。 pC(g)+qD(g)经5 min后达到平衡,测得此时A的浓度减少了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又测得平均反应速率v(C)=2v(B),达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为( )
pC(g)+qD(g)经5 min后达到平衡,测得此时A的浓度减少了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又测得平均反应速率v(C)=2v(B),达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为( ) B(g)+xC(g),在一定条件下达到平衡后,容器内压强增大了p%,A的转化率为2p%,则x的值为 ( )
B(g)+xC(g),在一定条件下达到平衡后,容器内压强增大了p%,A的转化率为2p%,则x的值为 ( )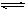 2NO2,测得平衡混合物对空气的相对密度为2.644,求N2O4的分解率。
2NO2,测得平衡混合物对空气的相对密度为2.644,求N2O4的分解率。

 CO(g)+H2(g),已达平衡状态,现欲使平衡向正反应方向移动,且v(正)增大,可进行的操作是( )
CO(g)+H2(g),已达平衡状态,现欲使平衡向正反应方向移动,且v(正)增大,可进行的操作是( )