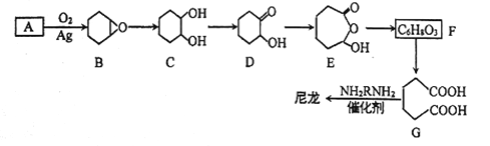
题目内容
【题目】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
乙醇水蒸气重整制氢的部分反应过程如下左图所示:
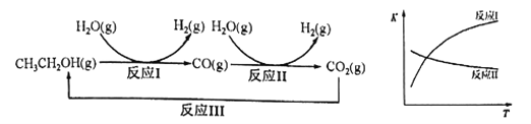
已知:反应Ⅰ和反应Ⅱ的平衡常数随温度变化曲线如上右图所示。
(1)反应Ⅰ中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ。反应1的热化学方程式是_____________________。
(2)反应Ⅱ,在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。
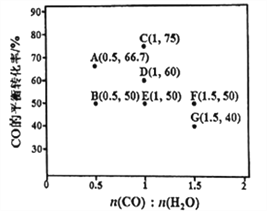
①图中D、E两点对应的反应温度分别为TD和TE判断:TD_______TE (填“<”“=”或“>”)。
②经分析,A、E 和G 三点对应的反应温度相同,其原因是A、E和G三点对应的________相同。
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系
是_________________。
(3)反应Ⅲ,在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
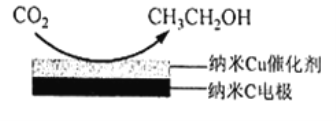
①阴极的电极反应式是____________________。
②从电解后溶液中分离出乙醇的操作方法是_________________。
③直接向KOH溶液中通入CO2,可以获得“经CO2饱和处理的KHCO3电解液”,该过程中浓度先增大后减小的离子是__________________ (填化学式)。
【答案】 CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) △H=+256 kJ·mol-1 < 化学平衡常数 进气比越大,反应温度越低 14CO2+12e-+9H2O→CH3CH2OH+12HCO3- 蒸馏 CO32-
【解析】试题分析:由反应Ⅰ和反应Ⅱ的平衡常数随温度的变化曲线可知,反应I是吸热反应、反应II是放热反应。
(1)反应Ⅰ中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ,则反应1的热化学方程式是CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) △H=+256kJ·mol-1。
(2)①该反应为放热反应,温度升高后CO的平衡转化率减小,所以图中D、E两点对应的反应温度TD<TE。
②经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的化学平衡常数相同。
③反应II是一个反应前后气体分子数不变的放热反应。如果增大进气比[n(CO):n(H2O)],CO的转化率会降低,如果降低反应的温度,CO的转化率会增大。所以,当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是:进气比越大,反应温度越低。
(3)由题意可知,二氧化碳在阴极上被还原为乙醇。①阴极的电极反应式是14CO2+12e-+9H2O→CH3CH2OH+12HCO3-。②根据乙醇和水的沸点相差较大,从电解后溶液中分离出乙醇的操作方法可以选择蒸馏法。③直接向KOH溶液中通入CO2,可以获得“经CO2饱和处理的KHCO3电解液”,通入少量二氧化碳时,二氧化碳转化为碳酸根离子,若通入足量的二氧化碳,则碳酸根转化为碳酸氢根离子,所以,该过程中浓度先增大后减小的离子是CO32-。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】阿司匹林(乙酰水杨酸,![]() )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:

制备基本操作流程如下:
![]()
主要试剂和产品的物理常数如下表所示:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 易水解 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是________________________________。
(2)合成阿司匹林时,最合适的加热方法是______________________。

(3)提纯粗产品流程如下,加热回流装置如图:
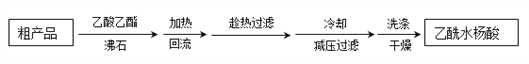
①沸石的作用是__________________________________;
②冷凝水的流出方向是________________(填“b”或“c”);
③使用温度计的目的是_____________________________________________________。
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(![]() ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。