题目内容
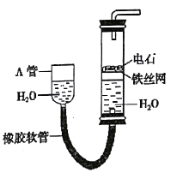
【题目】下列有关电化学的叙述,正确的是( )
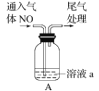
A. 装置工作时两极均有气泡产生,工作一段时间后溶液的碱性增强
装置工作时两极均有气泡产生,工作一段时间后溶液的碱性增强
B.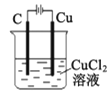 装置工作一段时间后碳极上有红色物质析出
装置工作一段时间后碳极上有红色物质析出
C.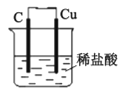 装置可以模拟金属的析氢腐蚀,铜棒一极的电极反应式为:2H++ 2e-=H2↑
装置可以模拟金属的析氢腐蚀,铜棒一极的电极反应式为:2H++ 2e-=H2↑
D.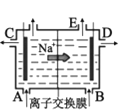 是阳离子交换膜法电解饱和食盐水原理示意图,E出口有黄绿色气体放出
是阳离子交换膜法电解饱和食盐水原理示意图,E出口有黄绿色气体放出
【答案】A
【解析】
A. 电解本质是电解水,石墨作阳极,发生氧化反应,其电极反应为:4OH--4e-=2H2O+O2↑,铁作阴极,发生还原反应,其电极反应为:2H++2e-=H2↑,水减小,氢氧化钠浓度增大,A正确;
B. 碳作阳极,铜作阴极,阴极上析出铜,B错误;
C. 铜不与稀盐酸反应,该装置是吸氧腐蚀,C错误;
D. 根据钠离子的移动方向可知,电解池的右边是阴极区,E口产生氢气,D错误;故答案为:A。

 优质课堂快乐成长系列答案
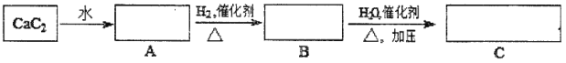
优质课堂快乐成长系列答案【题目】工业上制备 BaCl2·2H2O有如下两种途径。
途径 1:以重晶石(主要成分BaSO4)为原料,流程如下:
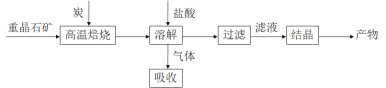
(1)写出“高温焙烧”时反应的化学方程式:_____________________________________。
(2)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为_____________。
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
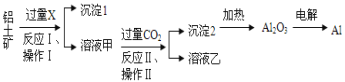
途径 2:以毒重石(主要成分BaCO3,含Ca2+、Mg2+、Fe3+等杂质)为原料,流程如下:
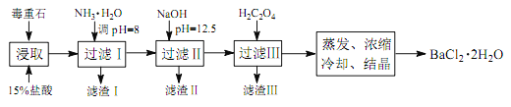
已知:Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(4)为提高矿石的浸取率,可采取的措施是_________。
(5)加入 NH3·H2O 调节 pH=8 可除去___________(填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(6)重量法测定产品纯度的步骤为:准确称取 m g BaCl2·2H2O试样,加入100 mL水, 用3 mL 2 mol·L-1 的 HCl溶液加热溶解。边搅拌,边逐滴加入0.1 mol·L-1 H2SO4 溶液。待BaSO4完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为n g。则BaCl2·2H2O的质量分数为_________。
(7)20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如图所示。下列叙述正确的是_______________
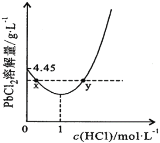
A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
【题目】某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
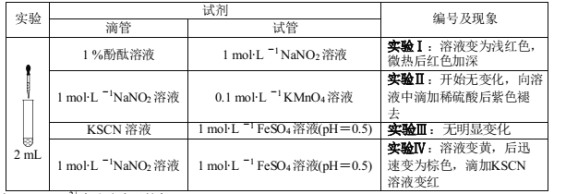
资料:[Fe(NO)] 2+在溶液中呈棕色。
(1)结合化学用语解释实验Ⅰ“微热后红色加深”的原因 ___;
(2)实验Ⅱ证明NO2-具有 ____性;
(3)实验Ⅳ证明NO2-具有_____性;写出此反应溶液先变黄后变成棕色的离子反应方程式 ____;
(4)探究实验Ⅳ中的棕色溶液
①为确定棕色物质是NO 与 Fe2+ 而非与 Fe3+ 发生络合反应的产物,设计如下实验,请补齐实验方案。
实验 | 溶液a | 现象 |
| 1mol/LFeSO4溶液(pH=0.5) | 溶液由________色迅速变为____色 |
__________________ | 无明显变化 |
②加热实验Ⅳ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因 ___ 。