题目内容
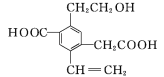
【题目】 是一种重要的化工原料,下列有关说法错误的是( )
是一种重要的化工原料,下列有关说法错误的是( )
A.该物质的分子式为C7H8O
B.该物质属于芳香族化合物的同分异构体共有4种(不包括其本身)
C.该分子中所有碳原子共平面
D.1 mol该物质与足量的Na反应可产生11.2 L H2
【答案】D
【解析】
A. ![]() 分子中,由7个C原子、8个H原子、1个O原子,所以其分子式为C7H8O,A正确;
分子中,由7个C原子、8个H原子、1个O原子,所以其分子式为C7H8O,A正确;
B. 芳香族化合物含有苯环,![]() 的含苯环的同分异构体有:
的含苯环的同分异构体有: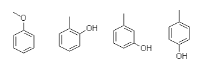 ,不包括其本身,共有4种,B正确;
,不包括其本身,共有4种,B正确;
C. 苯环中所有原子共面,与苯环相连的H被C取代后,也与苯环上的碳原子共面,所以该分子中所有碳原子共平面,C正确;
D. 1mol该物质与钠完全反应生成0.5molH2,其在标准状况下的体积为:11.2 L,D错误;故答案为:D。

【题目】实验室用浓度为0.500mol/L的标准氢氧化钠溶液来测定未知浓度的盐酸。在锥形瓶中放入20.00mL的待测溶液,再滴加2滴酚酞,摇匀。用标准氢氧化钠溶液滴定,直到滴入最后一滴氢氧化钠溶液,指示剂的颜色_______,并在半分钟内溶液颜色不发生变化,停止滴定,记录读数。数据如表:
次数 | 滴定前(mL) | 滴定后(mL) |
1 | 0.40 | 21.10 |
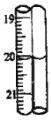
2 | 0.10 |
第2次滴定后滴定管的读数如图所示。根据表中的数据计算出盐酸的浓度为_____mol/L。
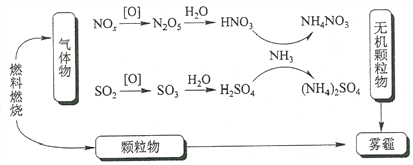
【题目】汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol1
甲烷直接将NO2还原为N2的热化学方程式为____________________________。
(2)减少汽车尾气污染的原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH <0。向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
N2(g)+2CO2(g) ΔH <0。向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/×10-3mol·L1 | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
c(CO)/×10-3mol·L1 | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①为了提高尾气处理的效果,可采取的措施有____________(写出两种即可)。
②此条件下达到平衡时,计算该反应的平衡常数K=____________________。
(3)工业上用氢氧化钠溶液来同时吸收SO2和氮的氧化物气体(NOx),可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。(已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8)。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是________溶液。
②常温下,NaHSO3显_________性(填“酸”“碱”或“中”),判断的理由是________________________________________________(通过计算说明)。
(4)铈素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。
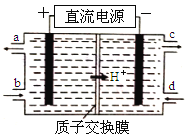
①Ce4+从电解槽的__________(填字母代号)口流出。
②写出阴极的电极反应式______________________。
【题目】正丁醚是一种用途很广的化工产品,毒性和危险性小,是安全性很高的有机溶剂,对许多天然及合成油脂、树脂、橡胶、有机酸酯、生物碱等都有很强的溶解能力,还可作为电子级清洗剂和多种有机合成材料。可通过以下反应原理制取正丁醚:
2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
己知相关物质的部分信息如下:
沸点(℃) | 密度(g/cm3) | 溶解度(g) | 相对分子质量 | |
正丁醇 | 117.7 | 0.81 | 7.9 | 74 |
正丁醚 | 142 | 0.77 | 不溶于水 | 130 |
某课外化学学习小组查阅相关资料设计了以下实验步骤合成正丁醚:
①在100 mL两口烧瓶中加入30.0 mL正丁醇、5.0 mL浓硫酸和几粒沸石,充分摇匀。在分水器中加入3.0 mL饱和食盐水,按图甲组装仪器,接通冷凝水;
②反应:在电热套上加热,使瓶内液体微沸,回流反应约1小时。当馏液充满分水器时,打开分水器放出一部分水。当水层不再变化,瓶中反应温度达150 ℃,反应己基本完成,停止加热;
③蒸馏:待反应液冷却后,拆下分水器,将仪器改成蒸馏装置如图丙,再加几粒沸石,蒸馏,收集馏分;
④精制:将馏出液倒入盛有10 mL水的分液漏斗中,充分振摇,静置弃去水液,有机层依次用5 mL水,3 mL 5% NaOH溶液、3 mL水和3 mL饱和氯化钙溶液洗涤,分去水层,将产物放入洁净干燥的小锥形瓶中,然后加入0.2~0.4 9无水氯化钙,再将液体转入装置丙中进行蒸馏,收集到馏分9.0 mL。
甲. 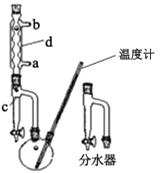 乙.
乙. ![]() 丙.
丙.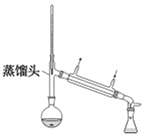
请根据以上操作回答下列问题:
(1)制备正丁醚的反应类型是___,仪器d的名称是____。
(2)在步骤①中添加试剂的顺序是____。相比装置乙,装置甲的优点是 ___。
(3)在步骤②中采用电热套加热而不采用酒精灯直接加热的原因可能是____。
(4)在步骤③中收集馏分适宜的温度范围为____(填正确答案标号)。
A.115℃~ll9℃ B.140℃~144℃ C. 148℃~152℃
(5)在精制中,有机层在____层(填“上”或“下”),加入无水氯化钙的作用是____。
(6)本小组实验后所得正丁醚的产率约为 ___%(计算结果保留一位小数)。