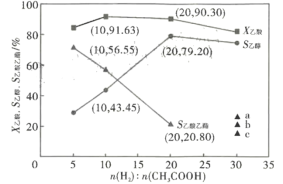
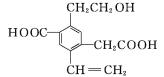
题目内容
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:
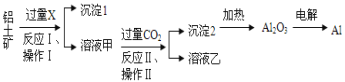
试回答下列问题:
(1)试剂X为__________;
(2)写出试剂X溶解Al2O3的化学方程式________
(3)操作Ⅰ、操作Ⅱ均为_________(填操作名称);
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为_______;
(5)反应Ⅱ的离子方程式为______;
(6)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是________g。
【答案】NaOH溶液 2NaOH+ Al2O3 = 2NaAlO2 + H2O 过滤 Al+Fe2O3![]() Al2O3+2Fe CO2+AlO2+2H2O=Al(OH)3↓+HCO3 4.05
Al2O3+2Fe CO2+AlO2+2H2O=Al(OH)3↓+HCO3 4.05
【解析】
铝土矿(主要成分为Al2O3,还有少量杂质)加入过量X发生反应生成沉淀1和溶液甲,溶液甲通入过量二氧化碳生成沉淀2为氢氧化铝,加热分解生成氧化铝,电解生成铝,判断过量试剂X为氢氧化钠溶液,操作Ⅰ为分离固体和溶液的过滤操作,通入过量二氧化碳过滤得到溶液乙主要为碳酸氢钠,
(1) 分析可知试剂X为氢氧化钠溶液;
(2) X为氢氧化钠溶液,与Al2O3反应生成偏铝酸钠和水;
(3)操作Ⅰ、操作Ⅱ都是分离固体和溶液的实验操作为过滤,结合过滤装置选择玻璃仪器;
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应,生成铁和氧化铝,反应放热可以焊接钢轨;
(5)反应Ⅱ是偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠;
(6)依据电极氧化铝的方程式中定量关系计算.
(1)分析可知试剂X为NaOH溶液,
故答案为:NaOH溶液;
(2)X为氢氧化钠溶液,与Al2O3反应生成偏铝酸钠和水,反应的化学方程式是:2NaOH+ Al2O3 = 2NaAlO2 + H2O ,
故答案为:2NaOH+ Al2O3 = 2NaAlO2 + H2O;
(3)操作Ⅰ、操作Ⅱ都是分离固体和溶液的实验操作为过滤,在实验室进行该操作时需要的玻璃仪器有漏斗、烧杯、玻璃棒,
故答案为:过滤;
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应,生成铁和氧化铝,反应的化学方程式为:2Al+Fe2O3![]() Al2O3+2Fe,反应放热可以焊接钢轨,
Al2O3+2Fe,反应放热可以焊接钢轨,
故答案为:Al+Fe2O3![]() Al2O3+2Fe;
Al2O3+2Fe;
(5)反应Ⅱ是偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式:CO2+AlO2+2H2O=Al(OH)3↓+HCO3,
故答案为:CO2+AlO2+2H2O=Al(OH)3↓+HCO3;
(5)电解熔融氧化铝制取金属铝,2 Al2O3![]() .4Al+3O2↑,反应中电子转移12mol生成铝3mol,若有0.6mol电子发生转移,理论上能得到金属铝的物质的量是0.6mol×3mol÷12mol=0.15mol,生成铝的质量=0.15mol×27g/mol=4.05g,
.4Al+3O2↑,反应中电子转移12mol生成铝3mol,若有0.6mol电子发生转移,理论上能得到金属铝的物质的量是0.6mol×3mol÷12mol=0.15mol,生成铝的质量=0.15mol×27g/mol=4.05g,
故答案为:4.05。

【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
B | 向1 mL浓度均为0.05 mol·L-l NaCl、NaI的混合溶液中滴加2滴0.01 mol·L-l AgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH | 比较HC1O和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇180℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A.AB.BC.CD.D