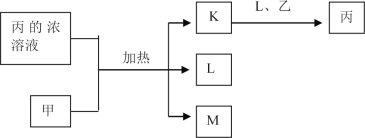
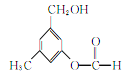
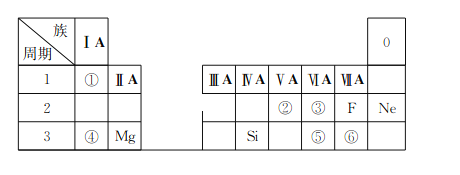
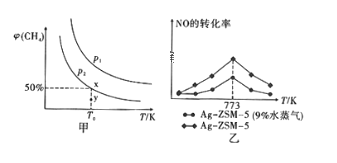
题目内容
【题目】利用N2O4通过电解法制备N2O5,反应方程式为N2O4+2HNO3=2N2O5+H2↑,工作原理如图所示,下列叙述正确的是
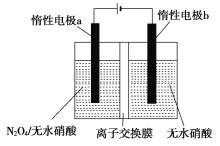
A.惰性电极a上发生还原反应
B.离子交换膜为阴离子交换膜
C.阳极区反应式为N2O4+2HNO3-2e-=2N2O5+2H+
D.反应时质子由右向左移动通过隔膜
【答案】C
【解析】
由电解装置示意图可知,与电源正极相连的惰性电极a为阳极,还原剂N2O4在阳极上失电子发生氧化反应生成N2O5,电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+,与电源负极相连的惰性电极b为阴极,氢离子在阴极上得电子发生还原反应生成氢气,电极反应式为2H++2e-=H2↑。
A项、惰性电极a为阳极,发生氧化反应,故A正确;
B项、电解时,阴极消耗氢离子,阳极生成氢离子,则氢离子向阴极移动,离子交换膜为阳离子交换膜,故B错误;
C项、与电源正极相连的惰性电极a为阳极,还原剂N2O4在阳极上失电子发生氧化反应生成N2O5,电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+,故C正确;
D项、电解时,阴极消耗氢离子,阳极生成氢离子,则氢离子由左向右移动通过隔膜,故D错误;
故选C。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
浓度/(mol/L)/时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 080 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=___mol·L-1·min-1;计算该反应的平衡常数K=__。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是__(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___(填“升高”或“降低”),△H__0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
2CH3OH(g) ![]() CH3OCH3(g)+H
CH3OCH3(g)+H
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式___。
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=__。[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
② 欲用5L Na2CO3溶液将23.3 g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积积的变化)
【题目】化学中存在许多平衡,如化学平衡、电离平衡、水解平衡、溶解平衡等等,对应的有化学平衡常数、电离平衡常数等。按要求回答下列问题:
(1)反应H2(g)+I2(g)2HI(g)的平衡常数为K1;反应HI(g)![]() H2(g)+
H2(g)+![]() I2(g)的平衡常数为K2,则K1、K2之间的关系式为___(平衡常数为同温度下的测定值)
I2(g)的平衡常数为K2,则K1、K2之间的关系式为___(平衡常数为同温度下的测定值)
(2)汽车净化原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是___。
2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是___。

(3)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-H++B2-。在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是___。
A.c(B2-)+c(HB-)=0.1mol/L B.c(B2-)+c(HB-)+c(H2B)=![]() c(Na+)
c(Na+)
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(4)下表为几种酸的电离平衡常数
CH3COOH | H2CO3 | H2S |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
则pH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序为___,少量CO2与NaHS反应的离子方程式为___。
(5)25℃时,向0.01molL-1的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为___;当Mg2+完全沉淀时,溶液的pH为___(忽略溶液体积变化,已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,已知lg2.4=0.4,lg7.7=0.9。
(6)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应:Fe(OH)3+3H+Fe3++3H2O的平衡常数K=___。