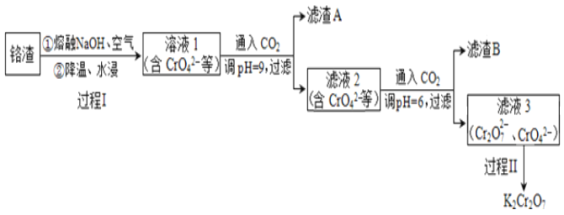
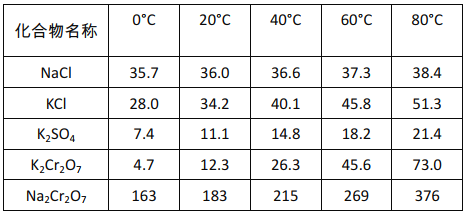
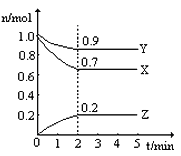
题目内容
【题目】下表列出了a~m13种元素在周期表(已省略了过渡元素)中的位置:
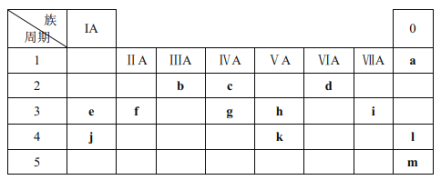
(1)元素b为___________(填名称);画出g的原子结构示意图_____________。
(2)元素f、i、j的原子半径从大到小的顺序是____________(用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是_______________(用离子符号表示)。
(3)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为_____________,该化合物中化学键有__________,该化合物与c的最高价氧化物反应的化学方程式为_________。
(4)根据元素周期表推测K元素及其化合物的性质正确的是(____)
A.气态氢化物的稳定性:K>h
B.K所在的主族元素通常用于制造农药和半导体材料
C.K的最高正价为+6
D.K的氢化物的沸点比NH3低
(5)用高能射线照射含有10电子的d元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子(含有10电子),试写出该阳离子的电子式:___________。
【答案】硼 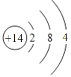 K>Mg>Cl Cl->K+>Mg2+
K>Mg>Cl Cl->K+>Mg2+  离子键、(非极性)共价键 2Na2O2+2CO2=2Na2CO3+O2 D
离子键、(非极性)共价键 2Na2O2+2CO2=2Na2CO3+O2 D ![]()
【解析】
由元素在周期表中的位置可以判断a、b、c、d、e、f、g、h、i、j、k、l、m分别为He、B、C、O、Na、Mg、Si、P、Cl、K、As、Kr、Xe等元素,结合元素周期律和相关物质的性质分析解答。
(1)元素b为硼;g是Si,原子序数是14,原子结构示意图为 。
。
(2)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则元素f、i、j的原子半径从大到小的顺序是K>Mg>Cl;核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则这三种原子分别形成简单离子后,离子半径从大到小的顺序是Cl->K+>Mg2+。
(3)元素O和Na形成的一种化合物为淡黄色固体,为过氧化钠,过氧化钠的电子式为 ,其中化学键有离子键、(非极性)共价键,该化合物与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。
,其中化学键有离子键、(非极性)共价键,该化合物与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。
(4)A.同主族从上到下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则气态氢化物的稳定性:K<h,A错误;
B.K所在的主族即第ⅤA元素通常用于制造农药,但一般不能制作半导体材料,B错误;
C.As的最高正价为+5价,C错误;
D.氨气分子间存在氢键,则As的氢化物的沸点比NH3低,D正确;
答案选D。
(5)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为:![]() 。
。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案