题目内容
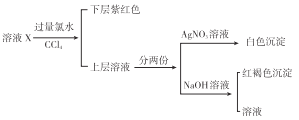
【题目】向新制饱和氯水中通入足量![]() 气体,不能使溶液
气体,不能使溶液![]()
![]()
A. 漂白性增强 B. 导电性增强 C. 酸性增强 D. 褪色
【答案】A
【解析】
在饱和氯水中通入SO2气体,发生SO2+Cl2+2H2O=H2SO4+2HCl,生成物盐酸和稀硫酸无漂白性,溶液中c(H+)增大,导电性增强,氯水因反应褪色,据此分析解答。
二氧化硫和氯气在水溶液中反应生成硫酸和盐酸,反应的方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;
A、向新制饱和氯水中通入足量![]() 气体,生成盐酸和稀硫酸无漂白性,漂白性减弱,故A不符合题意;
气体,生成盐酸和稀硫酸无漂白性,漂白性减弱,故A不符合题意;
B、溶液导电能力与离子浓度、所带电荷数有关,Cl2与水发生微弱的反应,产生少量H+、Cl-等,氯水中通入SO2,发生反应:SO2+Cl2+2H2O=H2SO4+2HCl,溶液中c(H+)、c(Cl-)、c(SO42-)离子浓度增大,溶液导电性增强,故B不符合题意;
C、在饱和氯水中通入![]() 气体,氯气和二氧化硫反应生成盐酸和硫酸,溶液中
气体,氯气和二氧化硫反应生成盐酸和硫酸,溶液中![]() 增大,酸性增强,故C不符合题意;
增大,酸性增强,故C不符合题意;
D、氯水为黄绿色,氯气和二氧化硫反应生成盐酸和硫酸,溶液褪色,故D不符合题意;

练习册系列答案
相关题目