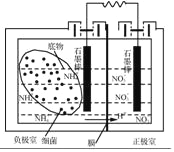
题目内容
【题目】实验室制取氯气的化学方程式:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2 +2H2O ,
Cl2↑+MnCl2 +2H2O ,
(1)反应物HCl中氯元素的化合价____,HCl在反应中表现的性质包括_______和______。
(2)在该氧化还原反应中,MnO2 做_________剂,锰元素被________。
(3)写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:_______________________。
【答案】-1 还原性 酸性 氧化 还原 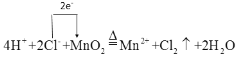
【解析】
(1)根据正负化合价代数和为0判断;还原剂具有还原性,化合价升高,失电子,被氧化;
(2)氧化剂具有氧化性,化合价降低,得电子,被还原;
(3)根据电荷守恒,得失电子数相等,原子守恒书写离子方程式;单线桥法箭头由还原剂指向氧化剂,根据化合价的变化写出转移电子数。
(1)反应物HCl中H为+1价,氯元素的化合价为-1价;HCl中有1/2的氯离子化合价升高失电子生成氯气,显示还原性;1/2的氯离子以酸根离子形式存在,显示酸性;
(2)在该氧化还原反应中,Mn元素的化合价降低,MnO2做氧化剂,锰元素被还原;
(3)只有溶于水的强电解质可以拆写成离子形式,故该反应的离子方程式为4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O;根据方程式可知反应中转移电子数为2e-,单线桥法标出电子转移的方向和数目为
Mn2++Cl2↑+2H2O;根据方程式可知反应中转移电子数为2e-,单线桥法标出电子转移的方向和数目为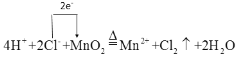 。
。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目