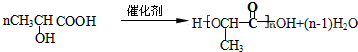
题目内容
18.一定条件下合成乙烯:6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g)△H1已知:2H2(g)+O2(g)=2H2O(g)△H2=-480kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g)△H3=-1400kJ•mol-1
(1)△H1=-40kJ•mol-1.请标出该反应电子转移的方向和数目
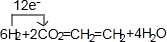 .
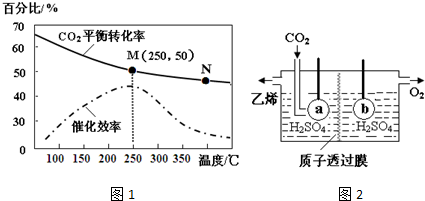
.(2)温度对CO2的平衡转化率和催化剂催化效率的影响如图1,下列说法正确的是AB.
A.生成乙烯的速率:v(M)有可能小于v(N)
B.平衡常数:KM>KN
C.催化剂会影响CO2的平衡转化率
(3)若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%(保留两位有效数字).
(4)为提高CO2的平衡转化率,除改变温度外,还可采取的措施有增大压强,或增大n(H2)/n(CO2)的比值,或增加c(H2)或将产物乙烯气体分离出来.(任写一条)
(5)电解法可制取乙烯(图2),电极a接电源的负极,该电极反应式为2CO2+12H++12e-→CH2=CH2+4H2O.
分析 (1)据已知热化学方程式,结合待求焓变的方程式利用盖斯定律解答;据反应前后化合价变化标电子转移的方向和数目;
(2)A、温度升高化学反应速率加快,催化剂的催化效率降低;
B、该反应是放热反应,升温平衡逆向移动;
C、催化剂只影响化学反应速率,不影响平衡移动;
(3)投料比n(H2):n(CO2)=3:1,M点时,二氧化碳的转化率为50%,则氢气的转化率也是50%,据此分析;
(4)要提高CO2的平衡转化率,需使平衡正向移动;
(5)据图分析,在酸性条件下二氧化碳电解生成乙烯和氧气,氧气在阳极生成,阴极生成乙烯;
解答 解:(1)已知:①2H2(g)+O2(g)=2H2O(g)△H2=-480kJ•mol-1
②CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g)△H3=-1400kJ•mol-1
据盖斯定律,①×3-②得:6H2(g)+2CO2(g)=CH2=CH2(g)+4H2O(g)△H1=(-480kJ•mol-1)×3-(-1400kJ•mol-1)=-40 kJ•mol-1,
氢气从0价变为+1价,C从+4价变为-2价,所以6mol氢气反应转移12mol电子, ,
,
故答案为:-40 kJ•mol-1;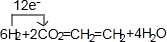 ;
;
(2)A、化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(M)有可能小于v(N),故A正确;
B、升温平衡逆向移动,化学平衡常数减小,故B正确;
C、催化剂只影响反应速率,不影响平衡移动和转化率,故C错误;
故答案为:AB;
(3)假设加入的氢气和二氧化碳分别为3mol和1mol,则M点时,有氢气1.5mol,二氧化碳0.5mol,乙烯0.25mol,水蒸气1mol,所以M点时乙烯的体积分数为$\frac{0.25}{1.5+0.5+0.25+1}$×100%=7.7%,故答案为:7.7%;
(4)加压、增大氢气浓度或减小生成物浓度都可以使平衡正向移动,二氧化碳的转化率增大,
故答案为:增大压强,或增大n(H2)/n(CO2)的比值,或增加c(H2)或将产物乙烯气体分离出来;
(5)据图分析,在酸性条件下二氧化碳电解生成乙烯和氧气,氧气在阳极生成,阴极生成乙烯,所以a接电源的负极,发生还原反应,电极反应式为2CO2+12H++12e-→CH2=CH2+4H2O,故答案为:负;2CO2+12H++12e-→CH2=CH2+4H2O.
点评 本题考查了盖斯定律的应用、据图象分析化学反应速率的影响因素、平衡计算、平衡移动、电极反应式书写,题目难度较大.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案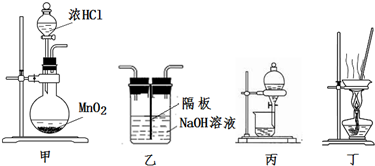
| A. | 用装置甲制取氯气 | |
| B. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| C. | 用装置乙吸收制取氯气的尾气 | |
| D. | 用装置丁蒸干氯化锰溶液制 MnCl2•4H2O |
| A. | 常温常压下,1mol21H2含有nA个质子 | |
| B. | 1molCu与足量FeCl3溶液充分反应转移了2nA个电子 | |
| C. | 含49gH2SO4的硫酸溶液中含有nA个氢原子 | |
| D. | 标准状况下,22.4L甲醇含有nA个分子 |
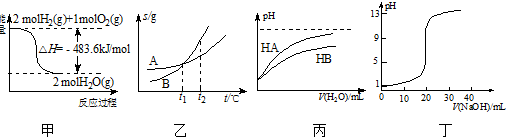
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| B. | 乙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(B)>ω( A) | |
| C. | 丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度NaB溶液的pH | |
| D. | 丁表示0.1000 mol•L-1 NaOH溶液滴定20.00 mL 0.1000 mol•L-1醋酸溶液得到的滴定曲线 |
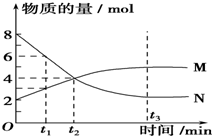
| A. | 化学方程式为:2M?N | B. | t3时,正逆反应速率相等 | ||
| C. | t3时,正反应速率大于逆反应速率 | D. | t1时,N的浓度是M浓度的3倍 |
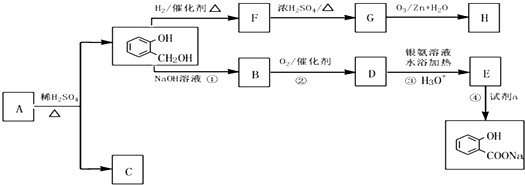
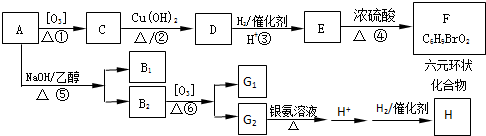
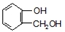 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验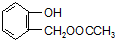 ,由F到G的反应类型为消去反应.
,由F到G的反应类型为消去反应.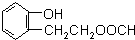 和
和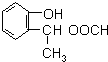 (不考虑立体异构).
(不考虑立体异构). .
.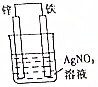 原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献. (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.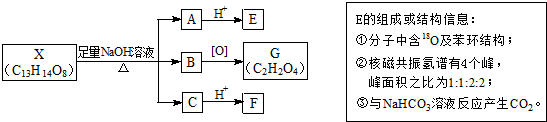
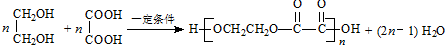 .
.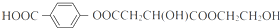 .
.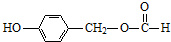 (写结构简式).
(写结构简式).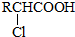
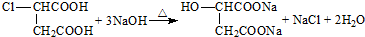 .
.
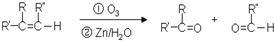
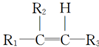 $\stackrel{[O_{3}]}{→}$
$\stackrel{[O_{3}]}{→}$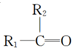 +
+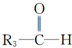
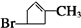

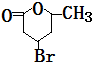 +H2O
+H2O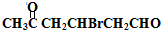 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$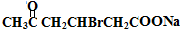 +Cu2O↓+3H2O
+Cu2O↓+3H2O