题目内容
3.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )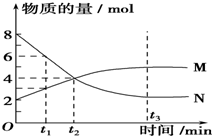
| A. | 化学方程式为:2M?N | B. | t3时,正逆反应速率相等 | ||
| C. | t3时,正反应速率大于逆反应速率 | D. | t1时,N的浓度是M浓度的3倍 |
分析 A、根据图象判断出反应物和生成物,根据物质的量的变化判断计量数之间的关系;
B、根据某一时间反应中各物质的物质的量是否变化判断反应是否达到平衡,根据平衡移动的方向判断正逆反应速率的关系;
C、根据某一时间反应中各物质的物质的量是否变化判断反应是否达到平衡,根据平衡移动的方向判断正逆反应速率的关系;
D、从图中看出t1时,N的物质的量为6mol,M的物质的量为3mol.
解答 解:A.达到平衡时,N的物质的量为2mol,变化6mol,M的物质的量为5mol,变化3mol,在相等的时间N和M的物质的量变化之比为2:1,所以反应方程式应为:2N?M,故A错误;
B.t3时,达到平衡状态,则正逆反应速率相等,故B正确;
C.t3时,达到平衡状态,则正逆反应速率相等,故C错误;
D.t1时,N的物质的量为6mol,M的物质的量为3mol,则N的浓度是M浓度的2倍,故D正确;
故选BD.
点评 本题考查化学平衡与图象问题的考查,侧重于学生的分析能力的考查,为高考常见题型,难度中等,注意把握图象曲线变化的趋势以及平衡状态的判断.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
11.反应4A(g)+3B(g)═2C(g)+D(g),2min后B的浓度减少0.6mol•L-1.对2min内反应速率的表示正确的是( )
| A. | 用A表示的反应速率是0.4mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率其比值为3:2:1 | |
| C. | 在2min末的反应速率,用B表示是0.3mol•L-1•min-1 | |
| D. | 在2min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的 |
18. 苏丹红是许多国家禁止用于食品生产的合成色素,其中“苏丹红Ⅱ号”的结构简式如图所示.下列关于“苏丹红Ⅱ号”说法正确的是( )
苏丹红是许多国家禁止用于食品生产的合成色素,其中“苏丹红Ⅱ号”的结构简式如图所示.下列关于“苏丹红Ⅱ号”说法正确的是( )
 苏丹红是许多国家禁止用于食品生产的合成色素,其中“苏丹红Ⅱ号”的结构简式如图所示.下列关于“苏丹红Ⅱ号”说法正确的是( )
苏丹红是许多国家禁止用于食品生产的合成色素,其中“苏丹红Ⅱ号”的结构简式如图所示.下列关于“苏丹红Ⅱ号”说法正确的是( )| A. | 属于芳香族化合物,分子式为C18H16N2O | |
| B. | 分子中的所有原子一定位于同一平面上 | |
| C. | 分子中苯环上的一取代物共有12种 | |
| D. | 可以使酸性高锰酸钾溶液褪色 |
8.根据下列反应步骤,由2-丙醇转化为1,2-丙二醇的正确的反应类型的顺序是( )
| A. | 消去-取代-加成 | B. | 取代-消去-加成 | C. | 消去-加成-水解 | D. | 水解-取代-取代 |
15.原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数均与其电子层数相等.Y能分别与X、Z形成原子个数比为1:3的共价化合物,常温下YX3是一种刺激性气味的气体.下列说法正确的是( )
| A. | 原子半径:Z<Y<W,而离子半径:W<Y<Z | |
| B. | 含W的盐溶液一定呈酸性 | |
| C. | 由X、Y、Z组成的盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 | |
| D. | W和Y形成的原子个数比为1:1的共价化合物,具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域,是一种原子晶体 |
12.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| B. | 标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA | |
| C. | 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| D. | 标准状况下,22.4L苯中C-H键数为6NA |
 .
. 路线:
路线:
 .
.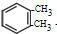 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$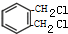 +2HCl
+2HCl