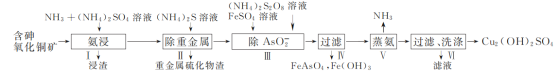
题目内容
【题目】工业所需氢气大部分由化学法制得,制取出过程中不可避免的会产生副产物CO、CO2、H2S等,CO选择性催化甲烷化技术可实现CO转化为CH4和H2O以达到净化氢气的目的。富氢气氛中CO和CO2甲烷化反应:
CO(g)+3H2(g)![]() CH4(g)+H2O(g)△H=-206.2kJmol-1
CH4(g)+H2O(g)△H=-206.2kJmol-1
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-165.0kJmol-1
CH4(g)+2H2O(g)△H=-165.0kJmol-1
回答下列问题:
(1)CO的转化率(![]() )及H2对CO的选择性(
)及H2对CO的选择性(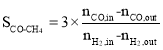 )是衡量工艺优劣的重要指标。其中nco,in及
)是衡量工艺优劣的重要指标。其中nco,in及![]() 分别为反应器入口CO、H2物质的量;nco,out及
分别为反应器入口CO、H2物质的量;nco,out及![]() 分别为反应器出口CO、H2的物质的量。
分别为反应器出口CO、H2的物质的量。
①以一定流速将富氢(含CO和CO2通过反应器 ,温度低于250℃时,在Ni-ZrO2-SiO2催化剂表面CO和CO2甲烷化速率均随温度升高而增大,则该温度范围内XCO将________(填“增大”“减小”或“无法判断”)。
②温度高于270℃反应CO2速率迅速增加,此时H2对CO的选择性开始________(填“升高”“下降”或“不变”)。
(2)恒温恒容条件下H2S发生分解反应,2H2S(g)![]() 2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol。
2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol。
①则初始时H2S的分压为________ 。
②该反应的Kp=________(Kp表示分压平衡常数,分压=总压×物质的量分数)。
(3)甲烷化过程中H2S会使催化剂中毒,下是图3个H2S在催化剂表面逐步解离的能量变化图:
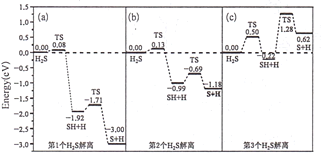
注:TS表示过渡状态
①(c)图中H2S的解离分为________步,决定分解速率快慢的是第________步.
②(b)图SH解离为硫原子和氢原子的反应热为________eV.
③Prodhomme研究发现H2S的解离难易与硫原子在催化剂表面吸附的多少有一定关系,观察上图预测该关系为________。
【答案】增大 下降 ![]() p
p ![]() p 二 二 -0.19 催化剂表面吸附的硫原子越多,越不利于H2S解离
p 二 二 -0.19 催化剂表面吸附的硫原子越多,越不利于H2S解离
【解析】
(1)反应达到平衡之前,温度越高反应越快,反应物的转化率越大;根据反应条件判断改变温度的时候,哪个反应受温度的影响比较大;
(2)根据反应前后反应物、生成物的变化量之比等于化学计量数之比,计算出平衡时反应物、生成物的物质的量,然后根据恒温恒容的容器中,压强之比等于物质的量之比,计算出反应后容器的总压强,根据分压=总压×物质的量分数,计算出平衡时反应物、生成物各自的分压,最后计算分压平衡常数;
(3)从图中找出H2S解离的过程,每一步解离能量的变化,反应的快慢取决于能垒比较高的,能垒越高反应速率越慢;根据反应热=生成物的总能量-反应物的总能量。
(1)①温度低于250℃时,在Ni-ZrO2-SiO2催化剂表面CO和CO2甲烷化速率均随温度升高而增大,说明温度低于250℃时,反应未达到平衡,故升高温度,化学反应速率加快,CO的转化率增大;
②温度高于270℃反应CO2速率迅速增加,则CO2和H2的转化率增大,c(H2)减小、c(CH4)增大,导致反应CO(g)+3H2(g) ![]() CH4(g)+H2O(g)的平衡逆向移动,CO的转化率降低,即nco,in—nco,out减小,
CH4(g)+H2O(g)的平衡逆向移动,CO的转化率降低,即nco,in—nco,out减小,![]() —
—![]() 增大,则H2对CO的选择性下降;
增大,则H2对CO的选择性下降;
(2)①初始投入2molH2S和1moH2,容器中的压强为p,则初始时H2S的分压为![]() p;
p;
②反应2H2S(g) ![]() 2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol,则反应消耗H2S的物质的量为2mol-1mol=1mol,根据化学反应中反应物、生成物的物质的量变化之比等于化学计量数之比,故平衡时生成的H2、S2的物质的量分别为1mol、0.5mol,故平衡后H2、S2的物质的量分别为1mol+1mol=2mol,0.5mol。恒温恒容条件下,反应前后压强之比等于总物质的量之比,令平衡后容器中的总压强为p1,则p:p1=3:(1+2+0.5),p1=
2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol,则反应消耗H2S的物质的量为2mol-1mol=1mol,根据化学反应中反应物、生成物的物质的量变化之比等于化学计量数之比,故平衡时生成的H2、S2的物质的量分别为1mol、0.5mol,故平衡后H2、S2的物质的量分别为1mol+1mol=2mol,0.5mol。恒温恒容条件下,反应前后压强之比等于总物质的量之比,令平衡后容器中的总压强为p1,则p:p1=3:(1+2+0.5),p1=![]() ,平衡后的分压p(H2S)=
,平衡后的分压p(H2S)=![]() ,p(H2)=
,p(H2)=![]() ,p(S2)=
,p(S2)=![]() ,Kp=
,Kp=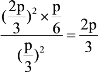 ;
;
(3)①由图(c)可知,H2S的解离分为两个过程:H2S →HS+S,HS →H+S,第二步能垒高,反应进行比较慢,决定整个反应的快慢,
②由图(b)可知HS解离为硫原子和氢原子为第二步过程,反应热为-1.18eV-(-0.99eV)=-0.19eV;
③由图(a)、(b)、(c)可知,解离第一个H2S的反应热为-3.0eV,解离第二个H2S的反应热为-1.18eV,解离第三个H2S的反应热为+0.62eV,即催化剂表面吸附的S原子越多,H2S的解离越难。