��Ŀ����
����Ŀ�����и�ͼ���ܱ�ʾ����ķ��ӽṹ����Ҫ��ش��������⡣
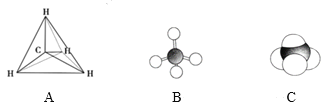
��1������ı���ģ����______(�����)��
��2����Է�������Ϊ100�������ķ���ʽ��_____��
��3��������![]() ��һ�ȴ�����_________�֣��������ȴ�����_________�֡�
��һ�ȴ�����_________�֣��������ȴ�����_________�֡�
��4���������ʵķе㰴�ɸߵ��͵�˳��������ȷ����___________��
��CH3(CH2)2CH3 ��CH3(CH2)3CH3 ��(CH3)3CH ��(CH3)2CHCH2CH3
A.�ڢܢ٢� B.�ܢڢ٢� C.�ܢۢڢ� D.�ڢܢۢ�
��5����֪��1mol H��H����1molO��H��g������1molO=O���ֱ���Ҫ��������436kJ��463kJ��496kJ����O2��H2��Ӧ����2molH2O��g�����ͷŵ�����Ϊ___________ kJ ��
���𰸡�C C7H16 1 3 A 484
��������
(1)����ԭ�Ӱ뾶C>H��ԭ��֮���γɹ��ۼ��������жϣ�
(2)������������ʽͨʽ��CnH2n+2�������㣻
(3)�����������ֻ��һ��Hԭ�ӣ�Hԭ�ӱ�Clȡ���õ�ȡ�����������ṹ�Գƣ�����1��H�����ȴ�����һ���⡢��Խ��ߡ���Խ�����3��λ�ã����ȴ�������ȴ����ͬ���칹����Ŀ��ͬ��
(4)�����к��е�Cԭ����Խ�࣬���ʷе�Խ�ߣ�������ʽ��ͬʱ��֧��Խ�٣����ʵķе�Խ�ߣ�
(5)��Ӧ��Ϊ���ѷ�Ӧ��Ļ�ѧ�����յ��������γ������ﻯѧ���ͷŵ������IJ���㡣
(1)��������������ṹ��Cԭ����4��Hԭ���γ��ĸ����ۼ�������ԭ�Ӱ뾶C>H�������γɹ��ۼ�ʱ�������ص�������������һ�����Լ���ı���ģ����C��
(2)��������ʽͨʽ��CnH2n+2������������Է���������14n+2=100,�����n=7�����Ը������ķ���ʽ��C7H16��
(3)����������ṹ��֪���������Ǹ߶ȶԳƵģ�������ֻ��һ��λ�õ�Hԭ�ӣ�������һ�ȴ���ֻ��һ�֣����������ʽ��C8H8����������ȡ����������������ȡ������������ͬ�����ȴ�����һ���⡢��Խ��ߡ���Խ�����3��λ�ã�һ�ȴ�����1�֣����ȴ�����3�֣������й�����8��Hԭ�ӣ������ȴ�������ȴ����ͬ���칹����Ŀ��ͬ��ͬ���칹����ĿΪ3�֣�
(4)�����������������ŷ�����̼ԭ�����ĵ����ʹ����Ա仯���е������ߣ�̼ԭ������ͬ������֧��Խ�࣬�۷е�Խ�͡�
�١�����̼ԭ�Ӷ���4��������֧�����е㣺�٣��ۣ��ڡ�����̼ԭ����Ϊ5���Ȣ١�����̼ԭ�������࣬��е�ϸߣ��ʷе㰴�ɸߵ��͵�˳�������Ǣڢܢ٢ۣ��ʺ���ѡ����A��
(5)������Ӧ2H2(g)+O2(g)=2H2O(g)������2mol H-H��1mol O=O��Ҫ���յ�����Ϊ436kJ��2+496kJ=1368kJ���γ�4mol H-O�ͷŵ�����Ϊ463kJ��4=1852kJ���ͷŵ������������յ����������Ը÷�ӦΪ���ȷ�Ӧ����Ӧ�ų�����Ϊ484kJ��

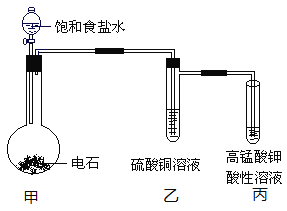
����Ŀ����ҵ����N2��H2�ϳ�NH3���Ʊ�H2�辭�ಽ��ɣ�������ˮú����CO��H2���任���Ǵ���H2�Ĺؼ�һ����
��1��ˮú���任��CO��g��+ H2O��g��![]() CO2��g�� + H2��g�����÷�Ӧ��H = +41 kJ/mol����41 kJ/mol��
CO2��g�� + H2��g�����÷�Ӧ��H = +41 kJ/mol����41 kJ/mol��
�� ƽ�ⳣ��K���¶ȱ仯���£�
�¶�/�� | 200 | 300 | 400 |
K | 290 | 39 | 11.7 |
���з�����ȷ����__________��
a. ˮú���任��Ӧ��H��0
b. ����ѹǿ���������CO��ƽ��ת����
c. ����ˮ����Ũ�ȣ�����ͬʱ����CO��ƽ��ת���ʺͷ�Ӧ����
�� �¶�ΪT1ʱ�����ݻ�Ϊ2 L ���ܱ������ס����зֱ����һ������CO��H2O��g����
����������£�
���� | �� | �� | ||
��Ӧ�� | CO | H2O | CO | H2O |
��ʼʱ���ʵ�����mol�� | 1.2 | 0.6 | 2.4 | 1.2 |
ƽ��ʱ���ʵ�����mol�� | 0.8 | 0.2 | a | b |
�ﵽƽ���ʱ�䣨min�� | t 1 | t 2 | ||
��. �������У���Ӧ��t1 min �ڵ�ƽ����Ӧ����v��H2��=_____mol/��L��min����
��. �������У�ƽ��ʱ����Ӧ�������仯Ϊ_____kJ��
��. T1ʱ����Ӧ��ƽ�ⳣ��K��= ______��
��. ��������a =______mol��
��2����ˮΪ���ռ��ѳ�CO2������ʧȥ��������ʱ��ͨ������ʹ���ռ��������û�ѧ����ʽ��ʾ�����������̣�___________________________________��
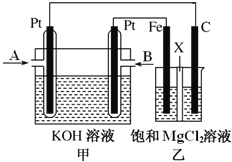
��3��2016���ҹ�ij�����Ŷ�������Ĥ��һ�������N2��H2������ԭ����ͼ��ʾ����������N2��O2�����ʵ���֮�Ȱ�4:1�ƣ���
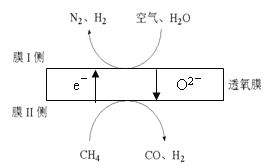
�� ��ԭ���õ�������_______��
�� Ĥ������ĵ缫��Ӧʽ��_______��
����Ŀ�������8�֣����в���Ԫ�ص�������ԭ��(�����)�ṹ���±���
Ԫ�ر�� | Ԫ��������ԭ��(�����)�ṹ |
T | �����������Ǵ�����������3�� |
X | �����µ���Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷ� |
Y | M���K����1������ |
Z | ��������Ԫ�صļ������а뾶��С |
(1)д��Ԫ��T��ԭ�ӽṹʾ��ͼ ��
(2)Ԫ��Y��Ԫ��Z��ȣ������Խ�ǿ����________(��Ԫ�ط��ű�ʾ)�����б�������֤����һ��ʵ����________(�����)��
a��Y���ʵ��۵��Z���ʵ�
b��Y�Ļ��ϼ۱�Z��
c��Y������ˮ��Ӧ��Z���ʾ���
d��Y����������ˮ����ļ��Ա�Zǿ
(3)T��X��Y��Z��������Ԫ�����γɼ������Ӽ����зǼ��Թ��ۼ��Ļ����д���û�����ĵ���ʽ��_____ _________��
(4)Ԫ��T����Ԫ�ؿ��γ�һ��18���ӵĻ�����Q��Ԫ��X����Ԫ��Ҳ�ܰ�ԭ�Ӹ�����Ϊ1��2�γ�һ��18���ӻ�����W��Q��W����������ԭ��Ӧ������X���ʺ�T����һ���⻯�д���÷�Ӧ�Ļ�ѧ����ʽ�� ��