题目内容
【题目】工业上由N2、H2合成NH3。制备H2需经多步完成,其中“水煤气(CO、H2)变换”是纯化H2的关键一步。
(1)水煤气变换:CO(g)+ H2O(g)![]() CO2(g) + H2(g),该反应的H = +41 kJ/mol或﹣41 kJ/mol。
CO2(g) + H2(g),该反应的H = +41 kJ/mol或﹣41 kJ/mol。
① 平衡常数K随温度变化如下:
温度/℃ | 200 | 300 | 400 |
K | 290 | 39 | 11.7 |
下列分析正确的是__________。
a. 水煤气变换反应的H<0
b. 增大压强,可以提高CO的平衡转化率
c. 增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
② 温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO和H2O(g),
相关数据如下:
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
达到平衡的时间(min) | t 1 | t 2 | ||
ⅰ. 甲容器中,反应在t1 min 内的平均反应速率v(H2)=_____mol/(L·min)。
ⅱ. 甲容器中,平衡时,反应的热量变化为_____kJ。
ⅲ. T1时,反应的平衡常数K甲= ______。
ⅳ. 乙容器中,a =______mol。
(2)以氨水为吸收剂脱除CO2。当其失去吸收能力时,通过加热使吸收剂再生。用化学方程式表示“吸收”过程:___________________________________。
(3)2016年我国某科研团队利用透氧膜,一步即获得N2、H2,工作原理如图所示。(空气中N2与O2的物质的量之比按4:1计)。
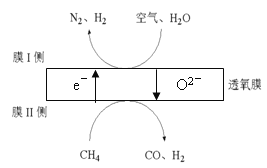
① 起还原作用的物质是_______。
② 膜Ⅰ侧发生的电极反应式是_______。
【答案】a c0.2/t116.411.6![]()
![]()
![]() 、
、![]()
【解析】
(1)①a项,由表可知,水煤气变换反应的平衡常数K随温度的升高而减小,所以该反应为放热反应,H<0,故a项正确;
b项,由反应方程式可知,反应平衡前后气体的体积不变,增大压强,平衡不移动,CO的平衡转化率不变,故b项错误。
c项,增大水蒸气浓度,活化分子浓度增大,反应速率增大,平衡正向移动,促进CO的转化,所以增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率,故c项正确;
综上所述,本题正确答案为ac。
②ⅰ.根据化学反应速率公式得:![]() ;
;
ⅱ. 根据热化学反应方程式CO(g)+ H2O(g)![]() CO2(g) + H2(g),H =﹣41 kJ/mol,反应0.4mol水蒸气,反应放出的热量为0.4mol×41 kJ/mol=16.4 kJ;
CO2(g) + H2(g),H =﹣41 kJ/mol,反应0.4mol水蒸气,反应放出的热量为0.4mol×41 kJ/mol=16.4 kJ;
ⅲ.. 发生反应:CO(g)+ H2O(g)![]() CO2(g) + H2(g)
CO2(g) + H2(g)
反应前(mol):1.2 0.6 0 0
转化(mol): 0.4 0.4 0.4 0.4
平衡时(mol):0.8 0.2 0.4 0.4
在t1达到平衡状态时甲容器中,c(CO)=0.8mol÷2L=0.4mol/L, c(H2O)=0.2mol÷2L=0.1mol/L , c(CO2)=0.4mol÷2L=0.2mol/L, c(H2)=0.4mol÷2L=0.2mol/L,则该温度下反应的平衡常数![]() ;
;
(4) CO(g)+ H2O(g)![]() CO2(g) + H2(g)为气体体积不变的反应,压强不影响化学平衡,则甲、乙互为等效平衡,达到平衡时反应物转化率相等,则:
CO2(g) + H2(g)为气体体积不变的反应,压强不影响化学平衡,则甲、乙互为等效平衡,达到平衡时反应物转化率相等,则:![]() ,计算得a=1.6;
,计算得a=1.6;
(2)氨水吸收CO2的反应为,氨水与二氧化碳反应,生成碳酸氢铵,化学方程式为:![]() 。
。
(3)①反应中,CH4中的C失去电子,所以起还原作用的物质是CH4;
②膜Ⅰ侧,H2O得电子生成H2和O2-,O2得电子生成O2-,发生的电极反应式为:![]() 、
、![]() 。
。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案