题目内容
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
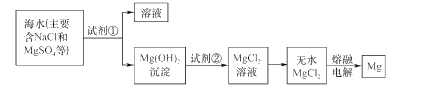
(1)为了使MgS04转化为Mg(OH)2,试剂①可以选用____(填化学式)。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是____。
(3)试剂②可以选用 ___(填化学式)。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:_________________。
【答案】 Ca(OH)2 过滤 HCl MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
【解析】本题考查海水中提取镁。
由流程图可知,海水中加入氢氧化钠,将硫酸镁转化成氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,通入蒸发浓缩、洗涤干燥得到干燥的氯化镁,然后电解熔融氯化镁获得金属镁。
(1)使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择Ca(OH)2,为了使镁离子完全转化,加入Ca(OH)2的量应过量。(2)过滤适用于不溶于水的固体和液体,氢氧化镁不溶于水,所以分离得到Mg(OH)2沉淀的方法是过滤。(3)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水。(4)电解熔融氯化镁得到镁和氯气,电解的化学方程式为:MgCl2![]() Mg+Cl2↑。
Mg+Cl2↑。

练习册系列答案
相关题目